
(11分)Fe、Cu都是人类最早使用的金属,某校化学研究性学习小组的同学运用实验的手段研究Fe、Cu以及化合物的相关性质.请你参与研究并回答下列问题:
(1)甲同学取两束细铜丝用砂纸打磨后在酒精灯上加热至红热,再分别伸到O2、Cl2的集气瓶中.你认为甲同学在实验中应该观察到的现象是___________________________.
(2)乙同学为验证Fe在冷的浓HNO3中发生钝化但能和热的浓HNO3反应,设计了如图所示的实验,请你指出其中的两处错误:________________________________________、______________________________________________________;纠正上述错误后,请你从绿色化学的角度出发,对装置2提出改进建议,使装置2既能控制反应的进行,又能减少氮氧化物的排放:__________________________________________.

(3)丙同学在Fe和浓HNO3反应后的溶液中加入一块Cu片,Cu片逐渐溶解,反应一段时间后不再溶解.
①丙同学依据反应现象得出Cu片溶解的原因是和HNO3发生反应.他依据的反应现象是________________________________.
②丁同学认为丙同学的结论不完全正确.他的理由是_________________________.
(4)请你设计实验证明在加入Cu片并反应完全后的溶液中含有Fe2+但不含有Fe3+.说明具体的操作和实验现象__________________________________________.
(1)Cu能在Cl2中燃烧,但不能在O2中燃烧
(2)两支试管中的液体均超过试管容积的三分之一
加热液体的试管应与桌面成45°角,向上倾斜而不应垂直向上 将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一段深入硝酸中,另一端伸出橡皮塞
(3)①试管上部出现红棕色气体 ②Fe和硝酸反应后的溶液中可能有HNO3,但一定有Fe3+,Fe3+也能和Cu反应而使Cu片溶解
(4)取该溶液少许,滴加适量的KSCN溶液,不出现红色,再滴加适量新制氯水,出现红色
【解析】(1)结合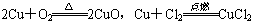 ,可预测观察到的现象为:灼热的铜丝可在氯气中燃烧,而在氧气中表面变黑,但不能燃烧.
,可预测观察到的现象为:灼热的铜丝可在氯气中燃烧,而在氧气中表面变黑,但不能燃烧.
(2)从实验基本操作入手,可观察到实验装置中的两处错误为:试管内的液体超过其容积的1/3,这样会导致加热时液体溅出伤人,在给试管里的液体加热时,必须使试管倾斜,与桌面呈45°夹角.
回顾Cu与浓硫酸反应的实验中将铜丝绕成螺旋状的做法,在本实验中将装置2中的铁片改成一段为螺旋状的铁丝,螺旋状的一段深入硝酸中,另一端伸出橡皮塞.
(3)①根据Cu与浓硝酸反应时最明显的现象是生成红棕色的NO2气体;②丁同学考虑问题时较全面,这是因为硝酸能与金属铜反应,Fe3+也能与金属Cu反应而使铜溶解.
(4)此问实际是Fe3+检验知识的应用,方法是:取该溶液少许,滴加适量的KSCN溶液,不出现红色,再滴加适量新制氯水,出现红色.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2013届四川省高二上学期期中考试化学试卷 题型:填空题
(11分)(1)在同一个原子中,离核越近、n越小的能层中的电子能量越 。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和 。现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
(2) N≡N的键能为946kJ·mol-1,N—N单键的键能为193kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,配离子 [Cu(NH3)4]2+的配体是 。
(4)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为 杂化,VSEPR构型为 ,分子的立体构型为 。
②BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(11分)(1)在同一个原子中,离核越近、n越小的能层中的电子能量越 。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和 。现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
(2) N≡N的键能为946kJ·mol-1,N—N单键的键能为193kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,配离子 [Cu(NH3)4]2+的配体是 。
(4)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为 杂化,VSEPR构型为 ,分子的立体构型为 。
②BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为 。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省双流中学高二上学期期中考试化学试卷 题型:填空题
(11分)(1)在同一个原子中,离核越近、n越小的能层中的电子能量越 。理论研究证明,多电子原 子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和 。现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级,分别为3s、3p和 。现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
(2) N≡N的键能为946kJ·mol-1,N—N单键的键能为193kJ·mol-1,计算说明N2中的 键更稳定(填“σ”或“π”)。
(3)在配离子[Fe(SCN)]2+中,提供空轨道接受孤电子对的微粒是 ,配离子 [Cu(NH3)4]2+的配体是 。
(4)根据价层电子对互斥理论判断下列问题:
①NH3中心原子的杂化方式为 杂化,VSEPR构型为 ,分子的立体构型为 。
②BF3分子中,中心原子的杂化方式为 杂化,分子的立体构型为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com