
【题目】I 锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为___,SO32-分子的空间构型为____。
(2)二价锰的3种离子化合物MnCl2、MnS、MnO中晶格能最大的是___。
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为___。

(4)在配离子[Mn(CN)6]3-中存在的作用力有___(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
II 铜是人类最早使用的金属之一,铜的化合物丰富多彩。
(1)铜与N2O4在一定条件下可制备无水Cu(NO3)2。
①基态Cu的电子排布式为___。
②与NO3-互为等电子体的一种分子为__(填化学式)。
(2)邻氨基吡啶(![]() )的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
)的铜配合物在有机不对称合成中起催化诱导效应,其结构简式如图所示。
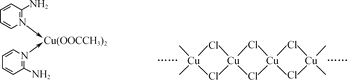
①C、N、O三种元素的第一电离能由大到小的顺序为___。
②邻氨基吡啶的铜配合物中,C原子轨道杂化类型为___。
③1mol![]() 中含有σ键的数目为___mol。
中含有σ键的数目为___mol。
【答案】1s22s22p63s23p63d5 三角锥形 MnO MnO2 bc 1s22s22p63s23p63d104s1或[Ar]3d104s1 SO3或BF3 N>O>C sp2、sp3 13
【解析】
I (1)Mn为25号元素,Mn2+基态核外电子排布式为1s22s22p63s23p63d5;
SO32-中S原子价层电子对=3+![]() (6+2-3×2)=4,且有一个孤电子对,所以其空间构型是三角锥型;
(6+2-3×2)=4,且有一个孤电子对,所以其空间构型是三角锥型;
(2)三种物质都是离子晶体,离子半径越小,离子键就越强,离子晶体的晶格能就越大,物质的熔点就越高,根据表格数据可知上表三种物质中晶格能最大的是MnO;
(3)由图可知,晶胞中Mn原子位于体心与顶点上,O原子位于上下两个面上及体内(有2个),故晶胞中Mn元素数目1+8×![]() = 2、O原子数目2+4×
= 2、O原子数目2+4×![]() =4,故答案为: MnO2;
=4,故答案为: MnO2;
(4)在配离子[Mn(CN)6]3-中,Mn2+与CN-间形成配位键,C与N之间形成共价键,
答案选bc;
II(1)①Cu是29号元素,其原子核外有29个电子,根据构造原理可知铜原子核外电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
②原子数和价电子数分别都相等的粒子互为等电子体,则与NO3-互为等电子体的一种分子为SO3或BF3;
(2)①同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C;
②形成配位键的N原子,没有孤电子对,杂化轨道数目为3,N原子采取sp2杂化,而氨基中N原子形成3个σ键、还有1对孤电子对,N原子杂化轨道数目为4,N原子采取sp3杂化;
③![]() 分子中含有4个C-H键、2个N-H键,2个C-N键,1个C一N键,2个C-C键,2个C一C键,分子中含有13个σ键,1mol 含有σ键的数目为13mol。
分子中含有4个C-H键、2个N-H键,2个C-N键,1个C一N键,2个C-C键,2个C一C键,分子中含有13个σ键,1mol 含有σ键的数目为13mol。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.1(b-2a)mol/LB. 10(2a-b)mol/LC. 10(b-a)mol/LD. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组进行如下实验:
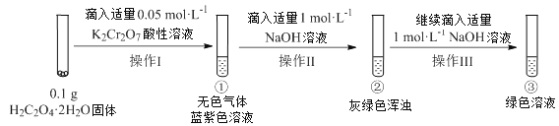
已知:Cr2(SO4)3稀溶液为蓝紫色;Cr(OH)3为灰绿色固体,难溶于水。
下列关于该实验的结论或叙述不正确的是
A. ①中生成蓝紫色溶液说明K2Cr2O7在反应中表现了氧化性
B. 若继续向③中加入稀硫酸,溶液有可能重新变成蓝紫色
C. 将①与③溶液等体积混合会产生灰绿色浑浊,该现象与Cr3+的水解平衡移动有关
D. 操作I中产生的无色气体是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:雾霾严重影响人们的生活与健康,某地区的雾霾中可能含有如下离子中的若干种:NH4+、Ba2+、Fe2+、Cl-、NO3-、CO32-、SO42-.某同学收集了该地区的雾霾,经必要的预处理后得到试样溶液,设计并完成如下实验:
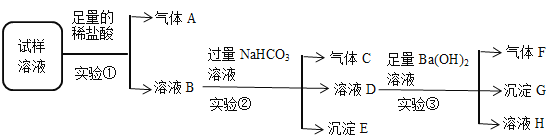
试回答下列问题:
(1)实验①中加入稀盐酸后,有无色气体A生成,气体A遇空气变成红棕色,溶液B依然澄清,且溶液中阴离子种类不变,据此可知原溶液中一定不含__________________。(填离子符号)
(2)实验①中发生反应的离子方程式为_________________________________。
(3)根据实验③现象该同学认为原溶液中一定含有SO42-,有其他同学认为其结论不合理,又进行了后续实验④,最终确认原溶液中含有SO42-,试写出实验④可行的操作方法及现象______________________________。
II :汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(4)氧化还原法消除NOx的转化如下:
![]()
①反应I为NO+O3 = NO2+O2,生成标准状况11.2 L O2时,转移电子的物质的量是______mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为___________。
(5)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。
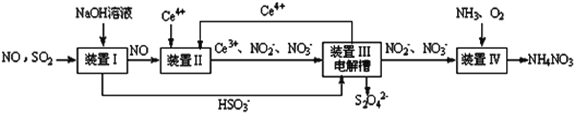
① 装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式________________
② 装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,同时在另一极生成S2O42-的电极反应式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、D、E、G是原子序数依次增大的五种短周期元素,A与E同主族,A、B和E的原子最外层电子数之和为19,B与G的单质都能与H2反应生成“HX”(X代表B或G)型氢化物,D为同周期主族元素中原子半径最大的元素。
(1)B在元素周期表中的位置是______。
(2)D的两种常见氧化物中均含有____________(填“离子键”或“共价键”)。
(3)E的最高价氧化物对应水化物的浓溶液和木炭共热,反应的化学方程式为____________。
(4)D的最高价氧化物对应水化物的溶液与G的单质反应,反应的离子方程式为___________。
(5)用原子结构解释“B、G单质都能与H2反应生成HX型氢化物”的原因:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种植物生长的调节剂,A进行如图所示的转化可制得有果香味的液体E(C4H8O2)。请回答下列问题:
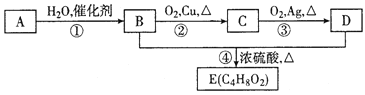
(1)A的电子式为___,D分子中所含官能团的名称为___。
(2)反应①的反应类型是____。
(3)A在一定条件下可以聚生成一种常见塑料,写出该塑料的结构简式___。
(4)请写出反应②的化学方程式__。
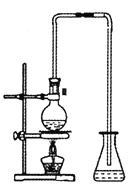
(5)实验室出反应④制备有机物E的装置如图,长导管的作用是导气和___,锥形瓶中盛放的液体是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向苯酚钠溶液中通入少量CO2:2C6H5O![]() +CO2+H2O→2C6H5OH+CO32-
+CO2+H2O→2C6H5OH+CO32-
B. NH4HSO3溶液与足量NaOH溶液反应:HSO![]() +OH-=SO32-+H2O
+OH-=SO32-+H2O
C. Fe(OH)2溶于稀HNO3:Fe(OH)2+2H+=Fe2++2H2O
D. H218O2中加入H2SO4酸化的KMnO4:5H218O2+2MnO![]() +6H+= 518O2+2Mn2++8H2O
+6H+= 518O2+2Mn2++8H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com