
����Ŀ��A���ɵ��Ȳ����Ƴɵ��ܱ�������B��һ�ͻ�ѧ��ʴ�����ڴ��ȵ����ر�K2����������������NO2ͨ��K1��K3�ֱ����A��B�У���Ӧ��ʼʱ��A��B�������ͬ��(��֪��2NO2 ![]() N2O4����H<0)
N2O4����H<0)

��1��һ��ʱ���Ӧ�ﵽƽ�⣬��ʱA��B�����ɵ�N2O4��������VA_______VB��(����>������<������=��)��������K2������B��___________(����С������)��
��2������A��B���ٳ������ʼ����ȵ�NO2����ﵽƽ��ʱ��NO2��ת������A��______(��������С������)����ͨ�������Ne������ﵽƽ��ʱ��A��NO2��ת���ʽ�_____��B��NO2��ת���ʽ�_______(� ���С������)��
��3�������£���A��B������������䣬��A����һ�����Ȳ㣬B�������Խ����ȴ��ݣ���ﵽƽ��ʱ��___________�е���ɫ���
���𰸡�< ��С ���� ���� ��С A
��������
��1���������֪��A�Ǻ��º��ݵ�װ�ã�B�Ǻ��º�ѹ��װ�á��÷�Ӧ�������С�ķ��ȷ�Ӧ���������ŷ�Ӧ�Ľ��У�A�е�ѹǿ��С����VA<VB��������K2���൱������װ�ñ�Ϊ���º�ѹ����������B����С��
��2���ٳ������ʼ����ȵ�NO2��A�Ǻ���װ�ã��൱������ѹǿ��ƽ�������ƶ���NO2��ת������A��������ͨ�������Ne����A�����ʵ�Ũ�Ȳ��䣬ƽ�ⲻ�ƶ���NO2��ת���ʲ��䣻��B�Ǻ�ѹװ�ã����������������ƽ�������ƶ���NO2��ת���ʱ�С��
��3���÷�ӦΪ���ȷ�Ӧ������A�����������Ȳ㣬���ŷ�Ӧ�Ľ��У�A���¶����ߣ�ƽ�������ƶ���NO2��Ũ����������A�е���ɫ���


 ����ѧУ�ֲ����ܲ�ϵ�д�
����ѧУ�ֲ����ܲ�ϵ�д� �ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
�ƸԺ���ȫ�����Ų��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и�ʵ��װ�õ������У�����ȷ���ǣ� ��
A.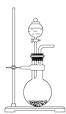 ������ʵ������ȡ����NH3��O2
������ʵ������ȡ����NH3��O2
B. ���ô�a����ˮ�ķ�������װ������������
���ô�a����ˮ�ķ�������װ������������
C. ʵ���ҿ���װ�����ռ�H2��NH3
ʵ���ҿ���װ�����ռ�H2��NH3
D. ��������������ƣ�����bΪ�����ӽ���Ĥ��cΪ�����ӽ���Ĥ
��������������ƣ�����bΪ�����ӽ���Ĥ��cΪ�����ӽ���Ĥ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����˵����ȷ����![]()
A.pHֵ��Ϊ4��ϡ�����![]() ��Һ�У�ˮ�ĵ���̶���ͬ
��Һ�У�ˮ�ĵ���̶���ͬ
B.Ũ�Ⱦ�Ϊ![]() �Ĵ����NaOH��Һ�������Ϻ�
�Ĵ����NaOH��Һ�������Ϻ�
C.�ں�Ũ�ȶ�Ϊ![]() ��
��![]() ��
��![]() �Ļ����Һ�еμ�
�Ļ����Һ�еμ�![]() ��Һ���ȳ��ֳ�������
��Һ���ȳ��ֳ�������![]() ��֪��
��֪��![]() ��
��![]()
D.Ũ�Ⱦ�Ϊ![]() ��
��![]() ��
��![]() ��Һ�У�
��Һ�У�![]() ��ͬ
��ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ������������ܵó���Ӧ���۵���![]()
ѡ�� | ���� | ���� | ���� |
A | ��KI�� | �²���Һ���Ϻ�ɫ | �����ԣ�
|
B | ��ʢ�� | 2min���Թ���������� | �ǽ����ԣ�
|
C |
| �ȳ��ְ�ɫ���������к��ɫ�������� | �ܽ�ȣ�
|
D | �� | �к�ɫ���� | ���ԣ�
|
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������п��Է��������������ЧӦ�Ļ�ѧ���ʡ����������ᣬ��ṹ��ʽ��ͼ��ʾ�������й�˵����ȷ����(����)

A.�����������������̼ԭ��ȫ������
B.�������ᱽ���ϵĶ��ȴ��ﹲ������
C.1 mol������������������������Ӧ���������5 mol H2
D.����������Է���ȡ����Ӧ��������Ӧ���кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶���ˮ�����ӻ�����ΪKw��������Һһ�������Ե��ǣ� ��
A.pH=7����ҺB.c(H��)��![]() mol��L��1����Һ
mol��L��1����Һ
C.��ǿ�ᡢǿ������ʵ�����Ӧ�õ�����ҺD.�ǵ��������ˮ�õ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش��������⣺
��1������������������ˮ�����侻ˮ��ԭ����___�������ӷ���ʽ��ʾ����
��2����25��ʱ��pH����9��pH����11����������������Һ�������Ϻ�����Һ����ı仯������Һ�е�������Ũ��Ϊ___��
��3���ֽ�0.2mol��L-1��NH3��H2O��Һ��0.1mol��L-1��HCl��Һ�������ϣ�д���û����Һ�����غ�ʽ��___��
��4��FeCl2��Һ���ɲ����յõ���������___���ѧʽ����
��5��Ũ�Ⱦ�Ϊ0.1molL��1�Ģ�H2S����NaHS����Na2S����H2S��NaHS���Һ����ҺpH�Ӵ�С��˳����___��������ű�ʾ��
��6���ڳ����£���������������Һ����0.1mol��L-1 CH3COONH4��Һ����0.1mol��L-1NH4HSO4��Һ����0.1mol��L-1 NH3��H2O��0.1mol��L-1 NH4Cl�����Һ����0.1mol��L-1 NH3��H2O��Һ���ȽϢ١��ڡ��ۡ�����Һ��c(NH4+)��С�����˳��Ϊ___������ű�ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���綾���軯��(NaCN)������ˮ�������ɾ綾��ȼ�� HCN ���壬ͬʱ HCN ������ˮ���ܣ����ˮ��Ⱦ����֪��������ĵ���ƽ�ⳣ�����±���
���� | HCOOH | HCN | H2CO3 |
����ƽ�ⳣ��(25��) | Ka��1.77��10-4 | Ka��5.0��10-10 | Ka1��4.3��10��7 |
Ka2��5.6��10-11 |
����ѡ��������( )
A.��NaCN��Һ��ͨ������CO2���������ӷ�ӦΪ2CN����H2O��CO2=2HCN��![]()
B.��ͬŨ�ȵ� HCOOH��NaCN ����Һ�У�ˮ�ĵ���̶�ǰ��С
C.�к͵��������pH �� HCOOH ��Һ�� HCN ��Һ���� NaOH �����ʵ���ǰ��С�ں���
D.������������ʵ���Ũ�ȵ� HCOONa �� NaCN ��Һ��������������ǰ�ߴ��ں���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���Һϳ����������IJ������£���ͼ��Բ����ƿ�ڼ����Ҵ���Ũ��������ᣬ���Ȼ���һ��ʱ�䣬Ȼ��ͼ��װ�ý������õ������Ҵ��������ˮ�����������ֲ�Ʒ��(���Ⱥͼг�װ��ʡ��)

��ش��������⣺
(1)�Ҵ���Ũ������Ҵ����ַ�Ӧ��ļ���˳����___________________������ƿ�г��˼����Ҵ���Ũ����������⣬��Ӧ����_________________��ͼ��������ˮ��_______________(a��b)����
(2)�ֱ�����ֲ�Ʒ����������������Ҵ��Ļ�������п�ͼ�Ƿ�������������̣�
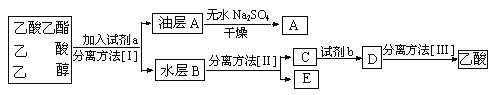
���Լ�a�ǣ�___________________�����뷽������___________________�����뷽������___________________���Լ�b��___________________(A��ŨHCI B��ŨH2SO4 C��ŨHNO3)��
(3)�ס�����λͬѧ�������ú����Ҵ��������ˮ�����������ֲ�Ʒ�ᴿ�õ�������������δ��ָʾ��������£����Ƕ����ȼ�NaOH��Һ�к����й������ᣬȻ��������������������ס�������������������£��õ��������Ե����Ļ����ҵõ��˴���ˮ���Ե����ʣ���ͬѧ����������ʵ��Ŀ��������Ϊ����ʵ��û�гɹ����Խ����������:
�ټ�ʵ��ʧ�ܵ�ԭ���ǣ�_________________________________________________________��
����ʵ��ʧ�ܵ�ԭ���ǣ�_________________________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com