
【题目】在密闭容器中进行如下反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1、0.2mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
A. Y2为0.2mol·L-1B. Y2为0.35mol·L-1
C. X2为0.2mol·L-1D. Z为0.4mol·L-1
【答案】B
【解析】
若反应向正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
X2(气)+Y2(气)2Z(气),
开始(mol/L):0.1 0.30.2
变化(mol/L):0.1 0.10.2
平衡(mol/L):0 0.20.4
若反应向逆反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
X2(气)+Y2(气)2Z(气),
开始(mol/L):0.1 0.30.2
变化(mol/L):0.1 0.1 0.2
平衡(mol/L):0.2 0.40
由于为可逆反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.2 mol/L,0.2 mol/L<c(Y2)<0.4 mol/L,0<c(Z)<0.4 mol/L,故B正确、ACD错误,故选B。


科目:高中化学 来源: 题型:
【题目】将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2 ![]() 2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
2SO3(正反应放热),反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是______。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时SO2的转化率______(用百分数表示)。(写出计算过程)
(3)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种物质在一定条件下具有如下图所示的转化关系,下列判断错误的是

A. 若图中反应均为非氧化还原反应,当W为一元强碱时,则Z可能是NaAlO2
B. 若图中反应均为氧化还原反应,当W为非金属单质时,则Z可能是CO2
C. 若图中反应均为非氧化还原反应,当W为一元强酸时则X可能是NH3
D. 若图中反应均为氧化还原反应,当W为金属单质时,则Z可能是FeCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙炔与苯蒸气完全燃烧的热化学方程式如下:
①C2H2(g)+![]() O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
②C6H6(g)+![]() O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
下列说法正确的是 ( )。
A. 1 mol C2H2(g)完全燃烧生成气态水时放热大于1 300 kJ
B. 1 mol C6H6(l)完全燃烧生成液态水时放热大于3 295 kJ
C. 相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多
D. C2H2(g)三聚生成C6H6(g)的过程属于放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、G五种短周期元素,原子序数依次增大。W、Z同主族,可形成离子化合物ZW;Y、M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性。请回答下列问题:
(1)Y在元素周期表中的位置为___________;
(2) W、Y、Z、G形成的简单离子的半径大小顺序是___________(用化学符号表示)
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有________ (任写两个)
(4)ZW的电子式为___________,W2Y2的电子式为______
(5)MY2和G2均能使品红溶液褪色,常温常压下若将相同体积的MY2和G2气体同时通入品红溶液,请用相关离子方程式解释原因________。
(6)已知
化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(7)最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如右图所示,已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N放出942kJ热量。根据以上信息和数据,下列说法正确的是___________ 。

A.N4属于一种新型化合物 B.N4晶体熔点高,硬度大
C.相同质量的N4的能量高于N2 D.1molN4转变为N2将吸收882kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2![]() mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
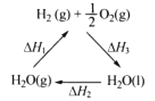
下列说法不正确的是
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 右图中△H1=△H2+△H3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A. 向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. 小苏打与氢氧化钠溶液混合:HCO3-+OH-=CO2↑+H2O
C. NaHSO4溶液与Ba(OH)2溶液混合后呈中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D. 二氧化锰和浓盐酸共热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A. Ba2+、Cu2+、NO3-、SO42-B. K+、Na+、SO42-、Cl-
C. CO32-、H+、Na+、K+D. H+、Cl-、NO3-、Ag+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com