
【题目】烃A是一种重要的化工原料,A的产量是衡量一个国家的石油化工水平的主要指标。B可发生银镜反应。F为有浓郁香味、不溶于水的油状液体。它们之间的转化关系如图。请回答:
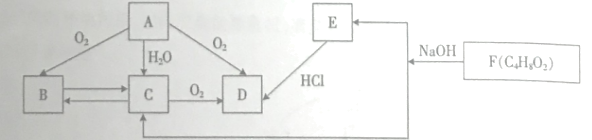
(1)C中含有的官能团名称是_________
(2)A与D也可在一定条件下生成F,该反应的反应类型为_________
(3)A在催化剂、加热条件下转化为B的化学方程式是_________
(4)下列说法正确的是_________
A F与NaOH溶液反应称为皂化反应
B 用新制碱性氢氧化铜悬独液可以区分B、C和D
C 给出氢离子的能力:D>C
D 实验室制备A和F时都需要使用浓硫酸,浓硫酸的作用完全相同
【答案】羟基 加成反应 2CH2=CH2+O2![]() 2CH3CHO BC
2CH3CHO BC
【解析】
烃A是一种重要的化工原料,A的产量是衡量一个国家的石油化工水平的主要指标,则A为乙烯。由图知,乙烯与氧气在一定条件下反应生成B、B可发生银镜反应,则B为乙醛,A即乙烯与水在一定条件下反应生成C、B即乙醛和C能相互转化,则C为乙醇, F为有浓郁香味、不溶于水的油状液体,能与NaOH溶液反应生成乙醇,则F为乙酸乙酯,E为乙酸钠,D为乙酸,据此回答;
(1)C为乙醇,含有的官能团名称是羟基;
答案为:羟基;
(2)A与D分别为乙烯和乙酸,也可在一定条件下生成F即乙酸乙酯,该反应的反应类型为加成反应;
答案为:加成反应;
(3)A即乙烯在催化剂、加热条件下转化为B即乙醛,则化学方程式是2CH2=CH2+O2![]() 2CH3CHO;
2CH3CHO;
答案为:2CH2=CH2+O2![]() 2CH3CHO;
2CH3CHO;
(4) A. F为乙酸乙酯,与NaOH溶液反应并不是皂化反应,油脂在碱性条件下的水解反应叫做皂化反应,A错误;
B. B、C和D分别为乙醛、乙醇和乙酸,各取少量加入新制碱性氢氧化铜悬独液产生不同现象:在加热条件下乙醛中会出现砖红色沉淀、乙醇中没有反应故得到含蓝色沉淀的悬浊液,乙酸中发生中和反应沉淀溶解得蓝色溶液,故可以区分,B正确;
C. C和D分别为乙醇和乙酸,乙酸有明显酸性,是一种弱酸,则给出氢离子的能力:D>C,C正确;
D. A和F分别为乙烯和乙酸乙酯,实验室制备乙烯时浓硫酸起催化剂和脱水剂作用,制备乙酸乙酯时浓硫酸起催化剂和吸水剂作用,D错误;
答案为:BC。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】红磷P(s)和Cl2(g)发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据),根据下图回答下列问题:

(1)PCl5分解生成PCl3和Cl2的热化学方程式__________________________;上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.8 mol PCl5,反应达到平衡时还剩余0.6 mol PCl5,其分解率α1等于____________;若反应温度由T1升高到T2,平衡时PCl5的分解率α2,α2____________α1(填“大于”、“小于”或“等于”)。
(2)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是______________________________________。
(3)P和Cl2分两步反应生成1 mol PCl5的ΔH3=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于周期表的_________区;溴的价电子排布式为____________________。
(2)在不太稀的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | 铍 | |
第一电离能 | 1681 | 1251 | 1140 | 1008 | 900 |
(4)已知高碘酸有两种形式,化学式分别为H5IO6( )和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
)和HIO4,前者为五元酸,后者为一元酸。请比较二者酸性强弱:H5IO6_____HIO4。(填“>”、 “<”或“=”)
(5)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大这是由于溶液中发生下列反应I-+I2=I3-。I3-离子的中心原子周围σ键电子对对数为_____,孤电子对对数为______, I3-离子的空间构型为___________。
与KI3类似的,还有CsICl2等。已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列_____式发生。 A.CsICl2=CsCl+ICl B.CsICl2=CsI+Cl2
(6)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(7)下图为碘晶体晶胞结构。有关说法中正确的是_____________。

A.碘分子的排列有2种不同的取向,2种取向不同
的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中的碘原子间存在非极性键和范德华力
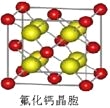
(8)已知CaF2晶体(见下图)的密度为ρg/cm3,NA为阿伏加德罗常数,相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离混合物的实验设计中不正确的是( )
A.除去![]() 固体中的碘单质——加热升华法
固体中的碘单质——加热升华法
B.从含有少量![]() 的
的![]() 固体中提取
固体中提取![]() ——溶解、蒸发浓缩、降温结晶、过滤
——溶解、蒸发浓缩、降温结晶、过滤
C.![]() 萃取碘水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
萃取碘水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
D.将溴水中的溴转移到有机溶剂中——加入酒精萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式的类推正确的是
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中Fe+Cu2+===Cu+Fe2+ | 将Na加入到CuSO4溶液中2Na+Cu2+===Cu+2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应至中性2H++SO42-+Ba2++2OH-===BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和碘单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O===CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有支链的芳香族化合物是重要的化工原料和合成中间体,以下是由丙烯为原料合成油墨材料DAP-A树脂的流程。
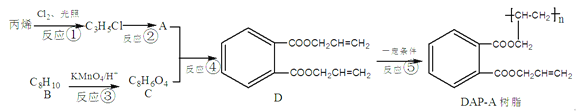
完成下列填空:
(1)D的分子式是____;反应④的条件是_____。
(2)写出结构简式A______;B__________。
(3)写出下列反应的化学方程式。
反应②:________________。
反应④:__________________________。
(4)符合下列条件的C的同分异构体共有___种。
①遇FeCl3溶液显紫色;②能发生银镜反应;③含有-COOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机金属化合物的应用研究是目前科学研究的前沿之一。二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如图所示。回答下列问题。
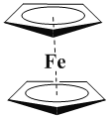

环戊二烯二茂铁
(1)环戊二烯分子中σ键和π键的个数比为___。
(2)下列关于环戊二烯和二茂铁的说法不正确的是__(填字母序号)。
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式___。
(4)已知环戊二烯阴离子(C5H5-)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有___(填字母序号)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:
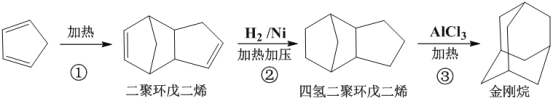
①金刚烷的分子式为____,反应①的反应类型是___。
②金刚烷的二氯代物有__种(不考虑立体异构)。
③二聚环戊二烯有多种同分异构体。写出符合下列条件的二聚环戊二烯的同分异构体的结构简式___。
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾![]() 和浓盐酸在一定温度下反应可制备黄绿色的氯气,其化学方程式为
和浓盐酸在一定温度下反应可制备黄绿色的氯气,其化学方程式为![]() 。
。
(1)浓盐酸在反应中表现出来的性质是_______(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)![]() 是_______(“氧化”或“还原”)产物;产生
是_______(“氧化”或“还原”)产物;产生![]() ,则转移电子的物质的量为____mol。
,则转移电子的物质的量为____mol。
(3)从铬元素![]() 的化合价态上判断,
的化合价态上判断,![]() 三种物质中的铬元素既表现氧化性又表现还原性的是_____________(写化学式,下同)。
三种物质中的铬元素既表现氧化性又表现还原性的是_____________(写化学式,下同)。
(4)已知氯气有毒,与水反应生成两种酸。实验室制备氯气可选用__________溶液进行尾气处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予三位分别来自法国、美国、荷兰的科学家,因其共同研究的“分子机器的设计与合成”。纳米分子机器日益受到关注,机器的“车轮”常用组件如图,下列说法正确的是( )
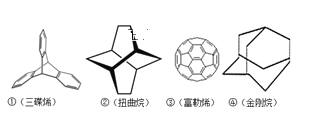
A.①②④互为同分异构体B.①②③④均属于烃
C.①②③④的一氯代物均只有3种D.①③均能发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com