
【题目】下列分离混合物的实验设计中不正确的是( )
A.除去![]() 固体中的碘单质——加热升华法
固体中的碘单质——加热升华法
B.从含有少量![]() 的
的![]() 固体中提取
固体中提取![]() ——溶解、蒸发浓缩、降温结晶、过滤
——溶解、蒸发浓缩、降温结晶、过滤
C.![]() 萃取碘水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
萃取碘水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
D.将溴水中的溴转移到有机溶剂中——加入酒精萃取
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是
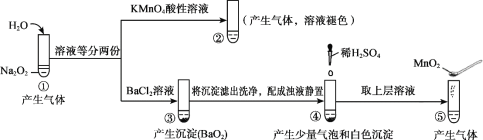
A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g)。可以判断该反应已经达到平衡的是
A.2v(NH3)=v(CO2)B.容器中总压强不变
C.容器中混合气体的平均相对分子质量不变D.容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是
千淘万漉虽辛苦,吹尽狂沙始到金 |
熬胆矾(CuSO4·5H2O) 铁釜,久之亦化为铜 |
凡石灰(CaCO3), 经火焚炼为用 |
丹砂(HgS)烧之成水银,积变又成丹砂 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在熔融状态下,Na与KCI存在可逆反应:Na+KCl![]() NaCl+K,通过调整温度,可利用金属Na来制取K。
NaCl+K,通过调整温度,可利用金属Na来制取K。
物质 | K | Na | KCl | NaCl |
熔点/℃ | 63.6 | 97.8 | 770 | 801 |
沸点/℃ | 774 | 883 | 100 | 1413 |
根据上表中各物质的熔点和沸点,推测由Na与KCl反应制取K的合适温度为
A.770℃B.800 ℃C.850 ℃D.900 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃A是一种重要的化工原料,A的产量是衡量一个国家的石油化工水平的主要指标。B可发生银镜反应。F为有浓郁香味、不溶于水的油状液体。它们之间的转化关系如图。请回答:
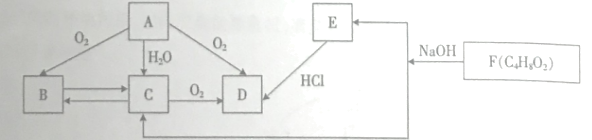
(1)C中含有的官能团名称是_________
(2)A与D也可在一定条件下生成F,该反应的反应类型为_________
(3)A在催化剂、加热条件下转化为B的化学方程式是_________
(4)下列说法正确的是_________
A F与NaOH溶液反应称为皂化反应
B 用新制碱性氢氧化铜悬独液可以区分B、C和D
C 给出氢离子的能力:D>C
D 实验室制备A和F时都需要使用浓硫酸,浓硫酸的作用完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某有机物在充有0.4 mol氧气的密闭容器中燃烧.产物为CO2、CO、H2O(g)组成的混合气。将该混合气依次缓慢通过浓硫酸、灼热的CuO、碱石灰,充分作用,浓硫酸增重10.8 g、CuO失重3.2 g、碱石灰增重17.6 g。
(1)请通过计算,推断该有机物的分子式_______________
(2)该有机物能与金属钠发生反应产生气体,写出可能的结构简式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物。u的水溶液具有漂白性;常温时,0.01mol/Lt与0.01mol/Lv溶液的pH均为2。下列说法正确的是( )
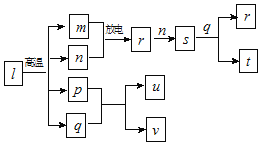
A.原子半径:r(X)<r(Z)<r(Y)
B.简单氢化物的稳定性:Y>Z>W
C.W的氧化物的水化物的酸性一定比Y的强
D.X、Y、Z三种元素形成的化合物只能抑制水的电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com