
【题目】0.2 mol某有机物在充有0.4 mol氧气的密闭容器中燃烧.产物为CO2、CO、H2O(g)组成的混合气。将该混合气依次缓慢通过浓硫酸、灼热的CuO、碱石灰,充分作用,浓硫酸增重10.8 g、CuO失重3.2 g、碱石灰增重17.6 g。
(1)请通过计算,推断该有机物的分子式_______________
(2)该有机物能与金属钠发生反应产生气体,写出可能的结构简式__________。
【答案】根据题意,燃烧产物中: n(H2O)=0.6 mol, n(CO)=0.2 mol, n(CO2)=0.2 mol,0.2mol有机物: n(H)=1.2 mol, n(C)=0.4 mol,n(O)=0.4 mol,有机物的分子式:C2H6O2 HOCH2CH2OH、 CH3OCH2OH
【解析】
浓硫酸具有吸水性,浓硫酸的质量增加10.8g为燃烧生成水的质量。通过灼热氧化铜,由于发生反应CuO+CO![]() Cu+CO2使固体的质量减轻,利用差量法可计算CO的质量。通过碱石灰时,碱石灰的质量增加了17.6g为CO2的总质量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据n=
Cu+CO2使固体的质量减轻,利用差量法可计算CO的质量。通过碱石灰时,碱石灰的质量增加了17.6g为CO2的总质量,减去CO与CuO反应生成的CO2的质量为有机物燃烧生成CO2的质量,根据n=![]() 计算各物质的物质的量。
计算各物质的物质的量。
(1)根据元素守恒计算有机物中C、H、O原子数目,进而求得化学式;
(2)分子中含有-OH,结合分子式据此书写结构简式;
(1)有机物燃烧生成水10.8g,其物质的量=![]() =0.6mol,令有机物燃烧生成的CO为x,则:CuO+CO
=0.6mol,令有机物燃烧生成的CO为x,则:CuO+CO![]() Cu+CO2,每有28gCO参加反应,固体质量减少16g,CuO失重3.2 g,所以m(CO)=
Cu+CO2,每有28gCO参加反应,固体质量减少16g,CuO失重3.2 g,所以m(CO)=![]() =5.6g,CO的物质的量=
=5.6g,CO的物质的量=![]() =0.2mol。根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g·mol-1=8.8g,有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为
=0.2mol。根据碳元素守恒可知CO与CuO反应生成的CO2的物质的量为0.2mol,质量为0.2mol×44g·mol-1=8.8g,有机物燃烧生成的CO2的质量为17.6g-8.8g=8.8g,物质的量为![]() =0.2mol,根据碳元素守恒可知,有机物分子中含有碳原子数目=
=0.2mol,根据碳元素守恒可知,有机物分子中含有碳原子数目=![]() =2,含有氢原子数目=
=2,含有氢原子数目=![]() =6,0.2mol有机物分子含有O原子物质的量=(0.6mol+0.2mol+0.2mol×2-0.4mol×2)=0.4mol,故分子中含有O原子数目=
=6,0.2mol有机物分子含有O原子物质的量=(0.6mol+0.2mol+0.2mol×2-0.4mol×2)=0.4mol,故分子中含有O原子数目=![]() =2,所以有机物的分子式为C2H6O2,故答案为:C2H6O2;
=2,所以有机物的分子式为C2H6O2,故答案为:C2H6O2;
(2)有机物能与金属钠发生反应产生气体,分子中含有-OH,可能有1个或2个羟基,可能的结构简式:HOCH2CH2OH、CH3OCH2OH,故答案为:结构简式: HOCH2CH2OH、CH3OCH2OH。


科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂空气电池如图所示。当电池工作时,O2与Li+在多孔碳材料电极处生成Li2O2-X(x=0或1)。下列说法正确的是
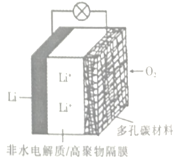
A.锂电极发生还原反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由锂电极流向多孔碳材料电极
D.正极的电极反应式为:O2+4e- +2H2O= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离混合物的实验设计中不正确的是( )
A.除去![]() 固体中的碘单质——加热升华法
固体中的碘单质——加热升华法
B.从含有少量![]() 的
的![]() 固体中提取
固体中提取![]() ——溶解、蒸发浓缩、降温结晶、过滤
——溶解、蒸发浓缩、降温结晶、过滤
C.![]() 萃取碘水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
萃取碘水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
D.将溴水中的溴转移到有机溶剂中——加入酒精萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有支链的芳香族化合物是重要的化工原料和合成中间体,以下是由丙烯为原料合成油墨材料DAP-A树脂的流程。
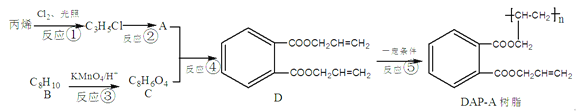
完成下列填空:
(1)D的分子式是____;反应④的条件是_____。
(2)写出结构简式A______;B__________。
(3)写出下列反应的化学方程式。
反应②:________________。
反应④:__________________________。
(4)符合下列条件的C的同分异构体共有___种。
①遇FeCl3溶液显紫色;②能发生银镜反应;③含有-COOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机金属化合物的应用研究是目前科学研究的前沿之一。二茂铁[(C5H5)2Fe]的发现是有机金属化合物研究中具有里程碑意义的事件,它开辟了有机金属化合物研究的新领域。二茂铁分子是一种金属有机配合物,熔点173℃,沸点249℃,100℃以上能升华;不溶于水,易溶于苯、乙醚、汽油等有机溶剂。环戊二烯和二茂铁的结构如图所示。回答下列问题。
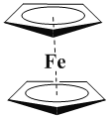

环戊二烯二茂铁
(1)环戊二烯分子中σ键和π键的个数比为___。
(2)下列关于环戊二烯和二茂铁的说法不正确的是__(填字母序号)。
A.环戊二烯分子中五个碳原子均发生sp2杂化
B.在一定的条件下,环戊二烯能与氢气发生加成反应生成环戊烷
C.二茂铁晶体是分子晶体
D.环戊二烯的同分异构体可能是含两个碳碳三键的炔烃
(3)环戊二烯能使溴的四氯化碳溶液褪色。写出环戊二烯与足量的溴的四氯化碳溶液反应的化学方程式___。
(4)已知环戊二烯阴离子(C5H5-)的结构与苯分子相似,具有芳香性。二茂铁[(C5H5)2Fe]晶体中存在的微粒间的作用力有___(填字母序号)。
a.离子键 b.σ键 c.π键 d.氢键 e.配位键
(5)金刚烷可用于抗病毒、抗肿瘤等特效药物的合成。工业上用环戊二烯合成金刚烷的流程如图所示:
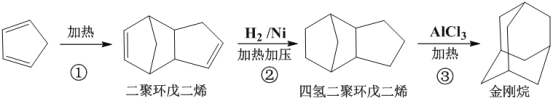
①金刚烷的分子式为____,反应①的反应类型是___。
②金刚烷的二氯代物有__种(不考虑立体异构)。
③二聚环戊二烯有多种同分异构体。写出符合下列条件的二聚环戊二烯的同分异构体的结构简式___。
(a)属于芳香烃且能使溴的四氯化碳溶液褪色;
(b)苯环上有三个取代基;
(c)苯环上的一氯代物有2种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的检验,说法正确的是_________(填字母代号)。
A.待检液加入稀![]() 酸化的
酸化的![]() 溶液,有白色沉淀生成,则原溶液中一定有
溶液,有白色沉淀生成,则原溶液中一定有![]() 存在
存在
B.待检液加入![]() 溶液,产生白色沉淀,则原溶液中一定有
溶液,产生白色沉淀,则原溶液中一定有![]() 存在
存在
C.待检液加入![]() 溶液并加热,有能使石蕊试液变蓝的气体生成,则原溶液中一定有
溶液并加热,有能使石蕊试液变蓝的气体生成,则原溶液中一定有![]() 存在
存在
D.待检液加入盐酸,产生无色无味的气体,则原溶液中一定有![]() 存在
存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾![]() 和浓盐酸在一定温度下反应可制备黄绿色的氯气,其化学方程式为
和浓盐酸在一定温度下反应可制备黄绿色的氯气,其化学方程式为![]() 。
。
(1)浓盐酸在反应中表现出来的性质是_______(填写编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)![]() 是_______(“氧化”或“还原”)产物;产生
是_______(“氧化”或“还原”)产物;产生![]() ,则转移电子的物质的量为____mol。
,则转移电子的物质的量为____mol。
(3)从铬元素![]() 的化合价态上判断,
的化合价态上判断,![]() 三种物质中的铬元素既表现氧化性又表现还原性的是_____________(写化学式,下同)。
三种物质中的铬元素既表现氧化性又表现还原性的是_____________(写化学式,下同)。
(4)已知氯气有毒,与水反应生成两种酸。实验室制备氯气可选用__________溶液进行尾气处理。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可以用如图所示装置制备、干燥、收集气体的是( )
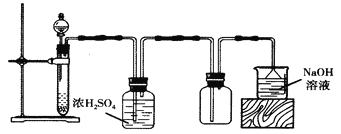
A. 以MnO2、浓盐酸为原料,制备Cl2
B. 以Na2SO3固体、质量分数为70%的浓硫酸为原料,制备SO2
C. 以浓氨水、生石灰为原料,制备NH3
D. 以Cu、稀硝酸为原料,制备NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是常见的三种单质,A、B、C及其他物质之间的反应关系如图所示,其中B、D、E、F的水溶液呈酸性。若D+C→E+F,且常温下只有B为气态,则A、B、C分别为

A. Fe、Cl2、Cu
B. Fe、Cl2、H2
C. Cu、Cl2、Fe
D. Fe、Cl2、Mg
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com