
【题目】2019年诺贝尔化学奖授予三位对锂电池研究作出杰出贡献的科学家。一种锂空气电池如图所示。当电池工作时,O2与Li+在多孔碳材料电极处生成Li2O2-X(x=0或1)。下列说法正确的是
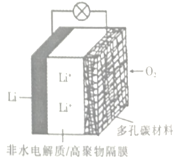
A.锂电极发生还原反应
B.多孔碳材料电极为负极
C.电池工作时外电路电子由锂电极流向多孔碳材料电极
D.正极的电极反应式为:O2+4e- +2H2O= 4OH-
科目:高中化学 来源: 题型:
【题目】实验室需要用质量分数为98%、密度为1.84g/cm3的浓硫酸配制1.0 mol·L-1的稀硫酸溶液450mL,请回答下列问题
(1)需要用量筒量取的浓硫酸的体积为__________mL。
(2)下面操作造成所配稀硫酸溶液浓度(填“偏高”、“偏低”或“无影响”)
①用量筒量取浓硫酸后洗涤量筒并把洗涤液转移到容量瓶__________。
②向容量瓶加水定容时眼睛俯视液面__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下反应:2KNO3+3C+S=K2S+N2↑+3CO2↑。其中被氧化的元素是____________,还原产物是____________。
(2)实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg=Cu2HgI4+2Cu。
①上述反应产物Cu2HgI4中,Cu元素显________价。
②以上反应中的氧化剂为________,当有1 mol CuI参与反应时,转移电子________mol。
③标明上述反应电子转移的方向和数目。____________________________。
(3)工业上常用酸性高锰酸钾溶液处理含有CuS和Cu2S的矿物,其反应原理如下:
8MnO4—+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4—+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
根据上述反应原理,某学习小组用400 mL 0.075 mol·L-1的酸性高锰酸钾溶液处理2 g含有CuS和Cu2S的混合物。反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1的(NH4)2Fe(SO4)2溶液完全反应。
①配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:______,MnO![]() +Fe2++H+=Mn2++Fe3++H2O
+Fe2++H+=Mn2++Fe3++H2O
②KMnO4溶液与固体混合物反应后,剩余KMnO4的物质的量为________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①②③④三种物质的分子式均为C9H12。下列说法正确的是( )
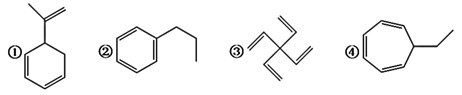
A.②和④与苯互为同系物
B.②和③的一氯代物都只有3种
C.①④分子中所有碳原子均可处于同一平面上
D.①②③都能发生加成反应和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分) 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O) ______ (填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
_____________________________________________________________________;
所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因:
_________________ 。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() 的溶液不一定呈碱性
的溶液不一定呈碱性
B.中和pH和体积均相等的氨水、![]() 溶液,所需
溶液,所需![]() 的物质的量相同
的物质的量相同
C.相同温度下,pH相等的盐酸、![]() 溶液中,
溶液中,![]() 相等
相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵固体置于密闭真空容器中(容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g)。可以判断该反应已经达到平衡的是
A.2v(NH3)=v(CO2)B.容器中总压强不变
C.容器中混合气体的平均相对分子质量不变D.容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.2 mol某有机物在充有0.4 mol氧气的密闭容器中燃烧.产物为CO2、CO、H2O(g)组成的混合气。将该混合气依次缓慢通过浓硫酸、灼热的CuO、碱石灰,充分作用,浓硫酸增重10.8 g、CuO失重3.2 g、碱石灰增重17.6 g。
(1)请通过计算,推断该有机物的分子式_______________
(2)该有机物能与金属钠发生反应产生气体,写出可能的结构简式__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com