
【题目】下列说法不正确的是( )
A.![]() 的溶液不一定呈碱性
的溶液不一定呈碱性
B.中和pH和体积均相等的氨水、![]() 溶液,所需
溶液,所需![]() 的物质的量相同
的物质的量相同
C.相同温度下,pH相等的盐酸、![]() 溶液中,
溶液中,![]() 相等
相等
D.氨水和盐酸反应后的溶液,若溶液呈中性,则![]()
【答案】B
【解析】
A. 温度影响水的电离,则pH>7的溶液不一定呈碱性;溶液酸碱性与溶液中氢离子、氢氧根离子浓度有关,当c(H+)<c(OH-) 时溶液一定呈碱性,故A正确;
B.pH相同的氨水和![]() 溶液,氨水的浓度更大,所以中和pH和体积均相等的氨水、
溶液,氨水的浓度更大,所以中和pH和体积均相等的氨水、![]() 溶液,氨水所需
溶液,氨水所需![]() 的物质的量更大,故B错误;
的物质的量更大,故B错误;
C.pH相同说明两种溶液中c(H+)相同,相同温度下Kw相同,Kw= c(H+)·c(OH-),溶液中氢离子浓度相同说明氢氧根浓度相同,故C正确;
D. 氨水和盐酸反应后的溶液中存在电荷守恒:c(OH-)+c(Cl-)=c(H+)+c(NH4+),溶液呈中性则c(H+)=c(OH-),所以![]() ,故D正确;
,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
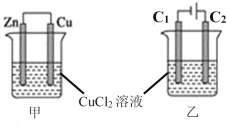
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻羟基桂皮酸(IV)是合成香精的重要原料,下列为合成邻羟基桂皮酸(IV)的路线之一。
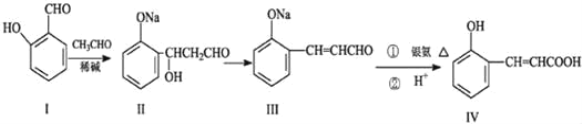
试回答:
(1)Ⅰ中官能团的名称______。
(2)Ⅱ→Ⅲ的反应类型______。
(3)①IV与乙醇在浓硫酸作用下发生酯化反应的方程式______。
②Ⅳ与过量NaOH溶液反应的化学方程式______。
(4)有机物X与IV互为同分异构体,且X有如下特点:
①是苯的对位取代物,②能与NaHCO3反应放出气体,③能发生银镜反应。请写出X的两种结构简式_______;
(5)下列说法正确的是_______。
A.Ⅰ的化学式为C7H8O2
B.Ⅰ遇氯化铁溶液呈紫色
C.Ⅱ能与NaHCO3溶液反应
D.1mol有机物IV最多能与4molH2加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO![]() 等离子,过程如下:
等离子,过程如下:
Ⅰ. 向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ. 向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ. 滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ除去的离子是______。
(2)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
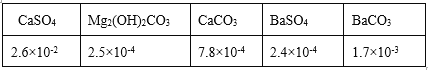
①检测Fe3+是否除尽的方法是______。
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因______。
③除去Mg2+的离子方程式是______。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO![]() 、NH
、NH![]() 、Ca2+、Mg2+,流程示意如下:
、Ca2+、Mg2+,流程示意如下:
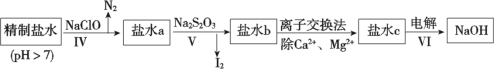
① 过程Ⅳ除去的离子是______。
② 盐水b中含有SO![]() 。Na2S2O3将IO
。Na2S2O3将IO![]() 还原为I2的离子方程式是________ 。
还原为I2的离子方程式是________ 。
③ 过程VI中,在电解槽的阳极发生反应的电极方程式是:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一如下:
含硫燃料![]() A
A![]() B
B![]() 硫酸
硫酸
请回答下列问题:
(1)A物质的化学式为________,B物质的化学式为________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生的途径可采取的措施是________。
A.少用煤作燃料 B.把工厂的烟囱造高
C.燃料脱硫 D.把工厂迁移到农村
E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________,理由是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上测量SO2、N2、O2混合气体中SO2含量的装置如图所示。反应管中装有碘的淀粉溶液。SO2和I2发生的反应(N2、O2不与I2反应)为SO2+I2+2H2O=H2SO4+2HI。
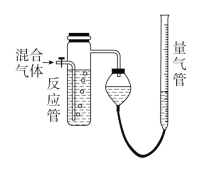
(1)混合气体进入反应管后,量气管内增加的水的体积等于________________(填气体的分子式)的体积。
(2)反应管内的溶液蓝色消失后,没有及时停止通气,则测得的SO2含量________(填“偏高”“偏低”或“不受影响”)。
(3)反应管内的碘的淀粉溶液也可以用________(填物质名称)代替。
(4)若碘溶液体积为Va mL,浓度为c mol·L-1。N2与O2的体积为Vb mL(已折算为标准状况下的体积)。用c、Va、Vb表示SO2的体积百分含量:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
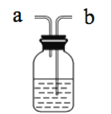
【题目】某学习小组用如图装置研究气体X的性质,气体X的主要成分是Cl2,其中含有少量水蒸气。请回答下列问题:

(1)分别描述B、C装置中的现象____;结合化学方程式及物质性质说明B、C装置中现象不同的原因____。
(2)Cl2是有毒气体,为了防止多余Cl2污染空气,可以在D处用如图装置进行尾气处理,用化学方程式表示该原理____。气体应该由____(填“a”或“b”)管通入。若要吸收224mLCl2(标况下),至少需要1mol/L的上述溶液____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上苯乙烯是合成树脂、离子交换树脂及合成橡胶等的重要单体,如图是苯乙烯的结构简式:![]() ,下列关于该有机物的说法不正确的是( )
,下列关于该有机物的说法不正确的是( )
A. 苯乙烯的分子式为C8H8
B. 苯乙烯通过加聚反应可制备高分子化合物
C. 苯乙烯与溴的四氯化碳溶液反应:![]()
D. 苯乙烯能发生加成反应,但不能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com