
【题目】如图所示,甲、乙两个装置的烧杯中分别盛有足量的CuCl2溶液。
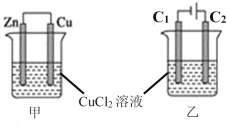
(1)甲装置中,Zn电极发生______反应(填“氧化”或“还原”),溶液中Cl-向_____极(填“Zn”或“Cu”)移动,Zn电极反应式为_______,若反应过程中有0.1mol电子发生转移,则Cu极质量增加__________。
(2)乙装置中,石墨电极C1是_______极,现象是______,C2极电极反应式为_______,若反应过程中阴极析出12.8g的Cu,则阳极产生的气体在标准状况下的体积为________。
【答案】氧化 Zn Zn-2e-=Zn2+ 3.2g 阴 有红色物质析出 2Cl--2e-=Cl2↑ 4.48L
【解析】
(1)活泼金属锌为负极,原电池中阴离子向负极移动,根据转移电子守恒分析解答;
(2)石墨电极C1与电源的负极相连作阴极,溶液中铜离子在阴极上放电生成单质铜,C2极与电源的正极连接,作阳极,氯离子失去电子,发生氧化反应,先计算12.8g的Cu的物质的量,然后根据同一闭合回路中转移电子相同,计算阳极产生的氯气的物质的量,由此分析解答。
(1)在甲装置中,Zn电极发生氧化反应,溶液中Cl-向正电荷较多的负极Zn移动,负极Zn失去电子,发生氧化反应,负极的电极反应式为Zn-2e-=Zn2+;若反应过程中有0.1mol电子发生转移,根据同一闭合回路中电子转移数目相等,可知在正极Cu上生成铜的物质的量为n(Cu)=0.1mol÷2=0.05mol,则Cu极质量增加m(Cu)=0.05mol×64g/mol=3.2g;
(2)石墨电极C1与电源的负极相连,作阴极,根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中Cu2+在阴极C1放电生成单质铜,因此看到的C1电极上的现象为有红色物质析出;C2极与电源的正极连接,作阳极,溶液中的阴离子Cl-失去电子,发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,12.8g的Cu的物质的量n(Cu)=12.8g÷64g/m=0.2mol,则转移电子的物质的量为n(e-)=2×0.2mol=0.4mol,则阳极产生的氯气的物质的量n(Cl2)=0.2mol,其标准状况下体积为V(Cl2)=n(Cl2)Vm=0.2mol×22.4L/mol=4.48L。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】
半导体材料磷化硼(BP)可由BBr3和PBr3在高温下合成。回答下列问题:
(1)基态P原子的价电子排布式为__________,同周期中第一电离能比P 小的元素有______种。
(2)在水中的溶解度BBr3_______PBr3(填“ >”或“ <”),原因是_____________。
(3)一定温度下PBr5能形成阴、阳离子个数比为1:1的导电熔体,经测定其中P—Br键键长均相等。写出该导电熔体中阳离子的电子式:_________,其中P原子的杂化轨道类型是_______。
(4)已知磷化硼晶体中P原子作A1型最密堆积,B原子填入四面体空隙中,相邻P原子和B原子核间距为d cm,则该晶体中每个B原子周围有_____个B原子与它距离最近,晶体密度为____g·cm-3(NA表示阿伏加德罗常数的值),若某个P原子的坐标为(0,0,0),则晶胞中其余P原子的坐标为__________(写出一个即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷、乙烯、乙醇都是重要的有机化合物。请回答下列问题:
(1)甲烷与氯气的第一步取代反应的化学方程式为_______。
(2)把乙烯通入到溴的四氯化碳溶液中,充分振荡、静置,观察到溴的四氯化碳溶液褪色,写出该过程中发生反应的化学方程式_______。
(3)下列几组物质中,互为同分异构体的是____;互为同系物的是____;同素异形体的是_____。
A.甲烷与新戊烷 B.氧气和臭氧 C.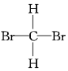 和
和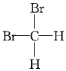
D.35Cl和37Cl E.CH3CH2OH和CH3OCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化石燃料开采、加工过程产生的H2S废气可以通过多种方法进行治理.可以制取氢气,同时回收硫单质,既廉价又环保。回答下列问题:
(1)已知:2H2(g)+O2(g)=2H2O(g) △H1
S(s)+ O2(g)=SO2(g) △H2
2S(s)![]() S2(g) △H3
S2(g) △H3
2H2S(g)+SO2(g)=3S(s)+2H2O(g) △H4
则反应2H2S(g)![]() 2H2(g)+ S2(g)的△H=_____
2H2(g)+ S2(g)的△H=_____
(2)工业上采州高温热分解HzS的方法制取H2,在膜反应器中分离出H2。
在恒容密闭容器中,阻H2S的起始浓度均为0.009 mol/L控制不同温度进行H2S分解:![]() ,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
,实验过程中测得H2S的转化率如图所示。曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度F反应经过相同时间时H2S的转化率。
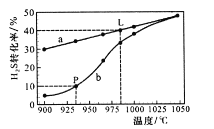
①在935℃时,该反应经过t s H2S的转化率达到P点数值,则在ts内用H2浓度变化表示的平均反应速率v(H2)=________。
②温度升高,平衡向____方向移动(填“正反应”“逆反应”),平衡常数____(填“增大”“减小”或“不变”)。985℃时该反应的平衡常数为________。
③随着H2S分解温度的升高,曲线b逐渐向曲线a靠近,其原因是___________。
(3)电解法治理硫化氢是先用FeCl3溶液吸收含H2S的工业废气,所得溶液用惰性电极电解,阳极区所得溶液循环利用。

①进入电解池的溶液中,溶质是____。
②阳极的电极反应式为________________。
③电解总反应的离子方程式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铜粉放入稀硫酸中,加热后无明显现象,但当加入某物质后,铜粉质量减少,溶液呈蓝色且有气体逸出,此物质是( )
A. Na2CO3 B. KNO3 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2.0 L的密闭容器内,物质D在T ℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是
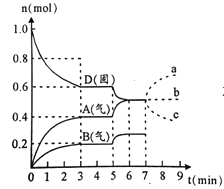
A. 从反应开始到第一次达到平衡时,A物质的平均反应速率为0.0667 mol/(L·min)
B. 该反应的化学方程式为2D(s) 2A(g)+B(g),该反应的平衡常数表达式为K=c(A)2·c(B)
C. 已知:反应的H>0,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com