
【题目】下图所示装置Ⅰ是—种可充电电池,离子交换膜只允许Na+通过,电池充放电的化学方程式为2Na2S2+ NaBr3![]() 3NaBr+Na2S4;装置Ⅱ为电解池,闭合开关K时,b极附近先变红色。下列说法正确的是
3NaBr+Na2S4;装置Ⅱ为电解池,闭合开关K时,b极附近先变红色。下列说法正确的是

A. 放电时,电极A的反应式为:2S22--2e-=S42-
B. 放电时,正极的反应式为:Br3- +2e-=3Br-
C. 装置Ⅰ放电时,Na+的移动方向为电极A→电极B
D. 装置Ⅱ若将a、b的铜棒、铅笔芯互换,反应现象仍然相同
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 多糖和蛋白质都是高分子化合物
B. 淀粉和纤维素分子式相同、结构不同,二者互为同分异构体
C. 蛋白质和多糖在一定条件下都能发生水解反应
D. 蛋白质具有酸碱两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 石油的产量是衡量一个国家化学工业水平的标志
B. 石油裂化既能提高汽油产量,又能提高汽油的质量
C. 石油的裂解和裂化都是化学变化,但二者的目的不一样
D. 烷烃在裂解过程中既可发生断链裂解又可发生脱氢裂解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述正确的是
A. 酸性高锰酸钾溶液可以检验出苯和乙醇的混合液中的乙醇
B. 与NaOH溶液反应且分子式为C2H4O2的有机物一定是乙酸
C. 丙烯分子中可能有8个原子共处于同一平面
D. 甲苯的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列有关说法正确的是
A. 酱油中加入氯化铁可以治疗缺铁性贫血
B. 融雪工业盐大多含有NaCl,因此可替代食盐食用
C. 食用油的主要成份是油脂,其成分与汽油、煤油相同
D. 《本草拾遗》记载“醋……消食,杀恶毒……”其中醋的有效成分是乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解尿素[CO(NH2)2]是一种能耗很低的制氢方法,其工作原理如图所示,总反应为CO(NH2)2+2OH-![]() N2↑+3H2↑+CO32-。下列说法错误的是
N2↑+3H2↑+CO32-。下列说法错误的是

A. 阴极的材料可选择钢铁制品
B. 电解池工作时,阳极区域溶液的pH减小
C. 阳极的电极反应式为CO(NH2)2+8OH--6e-==N2↑+ CO32-+6H2O。
D. 若电路中通过3 mol 电子,则生成气体的总体积为33. 6L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】瑞巴匹特为新型抗溃疡药,它可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
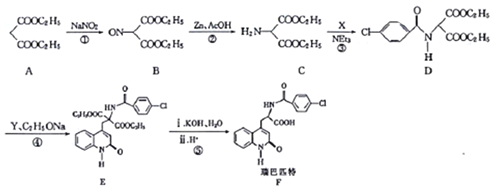
已知:Y的结构简式为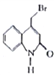
(1)A的化学名称为_______,A与足量NaOH溶液反应的化学方程式为___________。
(2)化合物C中官能团的名称为________。
(3)反应①的反应类型为______,反应②的反应类型为__________。
(4)C→D的转化过程中,生成的另一种产物为HCl,则X的结构简式为__________。
(5)芳香族化合物Z是X的同分异构体,能发生银镜反应且Z的核磁共振氢谱中有3组峰,则Z的结构简式为______(任写一种)。
(6)已知:①![]() HOCH2CH2CHO
HOCH2CH2CHO
②CH3CH2OH![]() CH3CH2Br。
CH3CH2Br。
请写出以A和![]() 为原料(无机试剂任选)制备
为原料(无机试剂任选)制备![]() 的合成路线流程图____。合成路线流程图示例如下:
的合成路线流程图____。合成路线流程图示例如下:
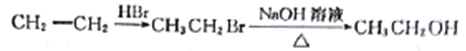
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学物质在生活、生产的运用描述不正确的是
A. 氢氧化钠能与二氧化硅反应,故常用氢氧化钠在玻璃上进行刻画
B. 工业上常用氨气来检查氯气管道是否泄漏
C. 氧化铝俗名刚玉,耐磨,常用于做轴承材料
D. 钠和鉀的合金呈液态,常做核反应堆的导热剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制400 mL 0.5 mol·L-1的NaOH溶液,试回答下列问题:
(1)计算:需要NaOH固体的质量为______。
(2)某学生用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现 指针在分度盘的偏右位置,此时左边的托盘将______(填“高于”或“低于”)右边的托盘。欲使天平平衡,所进行的操作为_______。假定最终称得小烧杯的质量为______(填“32.6 g”或“31.61 g”),
(3)配制方法:设计五个操作步骤:
① 向盛有NaOH的烧杯中加入200 mL蒸馏水使其溶解,并冷却至室温;
② 继续往容量瓶中加蒸馏水至液面接近刻度线1~2 cm处;
③ 将NaOH溶液沿玻璃棒注入500 mL容量瓶中;
④ 在烧杯中加入少量的蒸馏水,小心洗涤2~3次后移入容量瓶;
⑤ 改用胶头滴管加蒸馏水至刻度线,加盖摇匀。
试将以上操作排出先后顺序______。
(4)某学生实际配制NaOH溶液的浓度为0.48 mol·L-1,原因可能是______。
A.使用滤纸称量氢氧化钠固体 |
B.容量瓶中原来存有少量蒸馏水 |
C.溶解NaOH的烧杯未经多次洗涤 |
D.胶头滴管加水后定容时仰视刻度 |
(5)在下列配制0.5 mol·L-1NaOH溶液过程示意图中有错误的是(填序号)______。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com