
某同学用12.5 mol/L浓硝酸来配制500 mL1 mol/L的稀硝酸,并进行有关实验。请回答有关问题:
(1)需要量取12.5 mol/L的浓HNO3________mL,配制该稀硝酸时使用的仪器除量筒、玻璃棒、烧杯外,还必须用到的仪器有______、___________等。
(2)取所配制的稀HNO3200 mL,与一定质量的铜粉充分反应,铜粉全部溶解后,生成的唯一还原产物NO气体在标况下的体积为0.56L。则:写出Cu与稀HNO3反应的化学方程式 ,参加反应的铜粉的质量为_________g。
(3)若要将溶液中Cu2+全部转化为Cu(OH)2沉淀,至少需加入0.2mol/L的NaOH溶液的体积为 ml.
(注:要求在答题卡最下面方框内仅列出计算比例式)
(1)40 mL (2分)500mL容量瓶 (2分)胶头滴管 (2分)
(2)3Cu+8HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O ,2.4g(4分);
(3) 875ml.(4分)
解析试题分析:(1)稀释前后溶质的物质的量不变 0.5L×1mol/L=VL×12.5mol/L 所以V=0.04L,既是40ml ,(2)根据方程式中铜和一氧化氮的物质的量之比是3:2,mcu="0.56L/22.4L/mol" ×3/2 ×64g/mol=2.4g (3)根据氮元素守恒,0.2L 1mol/L 既是0.2mol 所以 nNaOH=nNaNO3=0.2mol-nNO=0.175mol 所以VL=n/c=0.175mol/0.2mol/L=0.875L
考点:本题考查了一定物质的量浓度溶液的配制,化学反应方程式的书写及相关物质的量的计算。


科目:高中化学 来源: 题型:填空题
氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)=2NH3(g) △H=―92.40 kJ·mol-1
2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=―159.47 kJ·mol-1
NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l) △H=+72.49 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为 。
(2)用丙烷和水为原料在电催化下制氢气,同时得到一种含有三元环的环氧化合物A,该反应的化学方程式为 。该反应也可生成A的同分异构体——另一种环氧化合物B,B的核磁共振氢谱为下图中的 (填“a”或“b”)。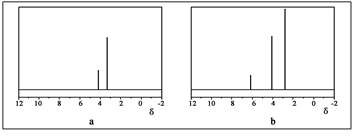
(3)已知叠氮酸(HN3)不稳定,同时也能与活泼金属反应,反应方程式为:
2HN3=3N2↑+H2↑
2HN3+Zn=Zn(N3)2+H2↑
2 mol HN3与一定量Zn完全反应,在标准状况下生成67.2 L气体,其中N2的物质的量为 。
(4)已知H2S高温热分解制H2的反应为:H2S(g) H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。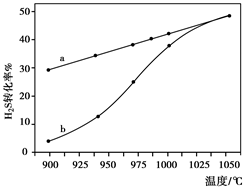
(5)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l)=CO2(g)+2H2(g)现将一定量的1 mol·L-1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL-1~0.12g·mL-1的煤浆液,置于右图所示装置中进行电解(两电极均为惰性电极)。则A极的电极反应式为 。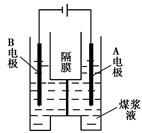
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取________mL上述浓盐酸进行配制。(保留小数点后1位)
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面。( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水。( )
(5)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足 B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线 D.加水时超过刻度线,用胶头滴管吸出
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
生态农业涉及农家肥料的综合利用,某种肥料经发酵得到一种含甲烷、CO2、氮气的混合气体2.016升(标准状况),该气体通过盛有红热CuO粉末的硬质玻璃管,发生反应:CH4+4CuO CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
(1)原混合气体中CH4的物质的量为________mol;
(2)原混合气体中N2的体积分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol·L-1。
(2)取用任意体积的该盐酸时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400 mol/L的稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制溶液除烧杯和玻璃棒,还需要的仪器是 、 、 。
③实验开始时,需要检查 。
④配制时,下列操作正确的顺序是(用字母表示) 。
A.洗涤 B.定容 C.溶解 D.摇匀 E.冷却 F.称量 G.转移
⑤在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填“偏大”、“偏小”或“无影响”)。
Ⅰ.用量筒量取浓盐酸时俯视观察凹液面( )
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水( )
Ⅲ.配制时,容量瓶有少量蒸馏水( )]
Ⅳ.定容时仰视刻度线( )
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)下列物质能导电的是 (填序号,下同),属于电解质的是 ,属于非电解质的是 。
①水银 ②CuSO4?5H2O ③大理石 ④氯化钠晶体 ⑤盐酸 ⑥氨气
⑦蔗糖 ⑧氯气 ⑨液态氯化氢 ⑩硫酸溶液
(2)按要求回答下列问题。
①Al2(SO4)3的电离方程式:
② NaHCO3的电离方程式:
③用化学方程式说明次氯酸钙粉末必须密封保存的原因:
④写出氯气与水反应的离子方程式:
(3)按要求完成下列填空:
①相同质量的氢气、甲烷、水,其中含分子数最多的是 。
②4.9 g H2SO4共含有 个原子。
③a个X原子的总质量为b g,则X的相对原子质量可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请完成下列填空:
(1)当SO2和SO3中分子个数比为1∶1 时,原子总数之比为 ,质量之比为 。
(2)中和含0.2 mol HCl的稀盐酸,需NaOH的质量为 g。
(3)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol—1,则:
①该气体的物质的量为 mol。
②该气体在标准状况下的体积为 L。
③该气体溶于水后形成V L溶液(不考虑反应),其溶液的物质的量浓度为 mol·L—1。
(4)将5 mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度是 mol·L—1。
(5)用等体积的0.1 mol·L—1的BaCl2溶液,可使相同体积的Fe2(SO4)3、Na2SO4、KAl(SO4)2三种溶液中的SO42—完全沉淀,则三种硫酸盐的物质的量浓度之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
无水AICl3可用作有机合成的催化剂,食品膨松剂等。工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下: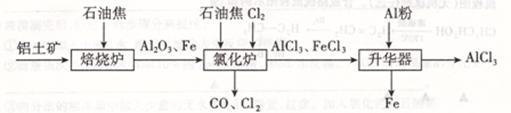
(1)在焙烧炉中发生反应:①Fe2O3(S) +3C(s) 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s) 2Fe(s)+3CO2(g).
2Fe(s)+3CO2(g).
则反应②的平衡常数的表达式为K= 。
(2)Al2O3、Cl2和C在氯化炉中高温下发生反应,当生成1molAlCl3时转移 mol电子;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为: 。
(3)升华器中发生反应的化学方程式为 。
(4)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱去结晶水制备无水AICl3,此反应必须在氯化氢的气流中加热,其原因是 。
已知SOCl2为无色液体且极易与水反应生成HC1和SO2,AlC13·6H2O与SOCl2混合加热可制取无水AlCl3,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
有同学研究从矿石开始到产出钢铁的工艺流程。
(1)将6.62g铁矿石样品投入足量的盐酸中完全溶解后过滤,滤渣中不含铁元素。在滤液中加过量的NaOH溶液,充分反应,过滤、洗涤、灼烧得4.80g Fe2O3。求该铁矿石含铁的质量分数。
(2)现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00吨生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(3)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。计算此钢样粉末中铁和碳的物质的量之比。
(4)再取三份不同质量的上述钢样粉末,分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com