
【题目】如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题. 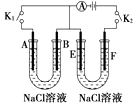
(1)打开K2 , 合并K1 . B为极,A的电极反应为 .
(2)打开K1 , 合并K2 . E为极,F极的电极反应为 , 检验F极产生气体的方法是 .
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 , 原因是 .
【答案】
(1)负; O2+4e﹣+2H2O═4OH﹣
(2)阴;2Cl﹣﹣2e﹣═Cl2↑;用湿润的淀粉﹣KI试纸检验,试纸变蓝则说明是氯气
(3)AE; A极上O2放电产生OH﹣,E极上水放电产生H2和OH﹣,均导致电极区域呈碱性
【解析】解:(1)当打开K2,闭合K1时,铁片、石墨和NaCl溶液构成原电池,负极为铁,电极反应式为:Fe﹣2e﹣═Fe2+,正极为石墨,正极的电极反应式为:O2+4e﹣+2H2O═4OH﹣,由于Fe2++2OH﹣═Fe(OH)2↓,4Fe(OH)2+O2+2H2O═4Fe(OH)3,所以可观察到的现象是:溶液中产生白色沉淀,然后变为灰绿色,最终变为红褐色,
所以答案是:负;O2+4e﹣+2H2O═4OH﹣;(2)当打开K1,闭合K2时,铁片、石墨和NaCl溶液构成电解池,阴极为铁,电极反应式为:2H++2e﹣═H2↑,阳极为石墨,电极反应式为:2Cl﹣﹣2e﹣═Cl2↑,检验Cl2的方法是:用湿润的淀粉﹣KI试纸检验,试纸变蓝则说明是氯气,
所以答案是:阴;2Cl﹣﹣2e﹣═Cl2↑;用湿润的淀粉﹣KI试纸检验,试纸变蓝则说明是氯气;(3)由于A极O2得到电子产生OH﹣,E极上水放电产生H2和OH﹣,均导致电极区域呈碱性,所以A、E电极周围遇酚酞变红,
所以答案是:AE;A极上O2放电产生OH﹣,E极上水放电产生H2和OH﹣,均导致电极区域呈碱性.


科目:高中化学 来源: 题型:
【题目】某单质A经如下图所示的过程,请回答下列问题:
![]()
(1)若A为淡黄色固体,B是有刺激性气味的无色气体。
①A、D的化学式分别为:A__________ D__________
②工业生产中大量排放的B气体被雨水吸收后形成___________而污染环境。
③写出B→C反应的化学方程式:__________________________________________
(2)若C为淡黄色固体。
①C的电子式为___________,C中阴阳离子数目比为_________
②写出C→D反应的离子方程式:___________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入富含溴离子的海水中,把溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有
①______________(写出离子方程式);
②3Br2+3CO32-===![]() +5Br+3CO2;
+5Br+3CO2;
③![]() +5Br+6H+===3Br2+3H2O。
+5Br+6H+===3Br2+3H2O。
其中反应②中氧化剂是________,还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:_______________。
(3)溶剂萃取法。该法是利用单质溴在水中和有机溶剂中溶解度不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是_______(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。
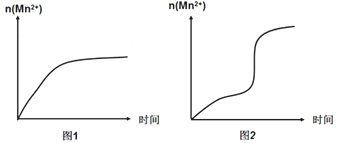
该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁、戊都是单质,其中甲、乙、丙是常见金属,丁和戊是气体,且丁呈黄绿色.A~K是化合物.F是红褐色沉淀,G是淡黄色固体粉末,D的溶液是蓝色的,K是丁的气态氢化物.已知乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1 . 它们之间有如图的转化关系(部分反应物或产物省略). 
回答以下问题:
(1)G的电子式:
(2)甲基态原子的电子排布式为 , 与同周期的金属元素相比,第一电离能由小到大的顺序是(用元素符号表示).
(3)反应②的离子方程式: .
(4)乙的高价阳离子的最高能级电子排布图为: . 检验该离子常用KSCN溶液.丙的外围电子排布式为 , 在元素周期表中的位置为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电导率传感器可绘制电导率曲线图,下图为用0.1mol/LNaOH溶液滴定10mL0.lmol/L盐酸过程中的电导率曲线。下列说法错误的是

A. 电导率传感器能用于判断酸碱中和滴定的终点
B. a、b、c 点的溶液中,离子浓度由大到小顺序为a>b>c
C. d点所示溶液中存在:c(Cl-) +c(OH-) =c(H+) +c(Na+)
D. C点电导率最小是因为此时溶液中导电微粒数目最少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A.用CuCl2溶液做导电实验,灯泡发光:CuCl2 ![]() Cu2++2Cl﹣
Cu2++2Cl﹣
B.铅蓄电池放电时,负极增重:Pb﹣2e﹣+SO42﹣=PbSO4
C.向碳酸钠溶液中滴加酚酞时,溶液变红:CO32﹣+2H2OH2CO3+2OH﹣
D.明矾可用于净水:Al3++3H2OAl(OH)3↓+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com