
【题目】已知铁的化合物之间有如下转化关系,
![]()
请回答下列有关问题:
(1)Fe与过量稀盐酸反应可以制取FeCl2。若用反应所得的酸性溶液,实现上述①的转化,要求产物纯净,可选用的试剂是_________(选填序号);
a.KMnO4 b.HNO3 c.H2O2
(2)硫酸铁可用于电化浸出黄铜矿精矿工艺。精矿在阳极浸出的反应比较复杂,其中有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S。(CuFeS2中S为-2价)则下列说法正确的是_________(选填序号);
a.从物质分类的角度看,黄铜矿属于合金
b.Cu2+和S是氧化产物
c.当转移1mol电子时,46g CuFeS2参加反应
d.反应中,CuFeS2既作氧化剂又作还原剂
(3)在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出。
①若滤出的固体中只有铜,则溶液中一定含有的阳离子是 ,一定不含的阳离子是 。
②若滤出的固体中含有铁和铜,则溶液中一定不含的阳离子是 。
(4)高酸钾(K2FeO4)是一种新型、高效的绿色水处理剂,和水发生水解反应生成Fe(OH)3胶体等物质,写出FeO42- 和H2O反应的离子方程式 。高酸钾作为水处理剂发挥的作用是_____________、_____________。 (用简洁的名词描述即可)
【答案】(1)c(1分)(2)c(1分)
(3)①Fe2+Fe3+②Fe3+Cu2+(4分、一个1分)
(4)4FeO4-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑(2分)杀菌(1分)净水(1分)
4Fe(OH)3+8OH-+3O2↑(2分)杀菌(1分)净水(1分)
【解析】
试题分析:
试题分析:(1)要使产物纯净,必须物质间发生反应后,没有杂质生成。a.KMnO4能氧化Fe2+生成Fe3+ ,但反应后引入了K+和Mn2+新杂质,错误;b.HNO3能氧化Fe2+生成Fe3+ ,但溶液中还有NO3-杂质离子,错误;c.H2O2能氧化Fe2+生成Fe3+ ,同时有水生成,水是原溶液的成分,所以不是杂质,正确。故选c。
(2)a.合金是由两种或两种以上的金属与非金属经一定方法所合成的具有金属特性的物质,所以黄铜矿不是合金,故a错误;b.CuFeS2中Cu元素的化合价为+2价,生成物中Cu2+的化合价为+2价,化合价没发生改变,所以Cu2+不是氧化产物,CuFeS2中S元素的化合价为-2价,生成物中S的化合价为0价,化合价升高,所以S是氧化产物,故b错误;c.根据反应CuFeS2+4Fe3+=Cu2++5Fe2++2S,在这个反应中转移4mol电子,消耗184g CuFeS2,则转移1mol电子时,有 46g CuFeS2参加反应,故c正确;d.CuFeS2中只有S元素的化合价升高,其他元素的化合价不变,所以CuFeS2只作还原剂,故d错误;故选c。
(3)向FeCl3、CuCl2混合溶液中加入一定量的铁屑,对应的反应为2FeCl3+Fe=3FeCl2,CuCl2+Fe=FeCl2+Cu。①若剩余的固体为铜,则反应后的溶液中含有的阳离子一定有Fe2+,一定不含Fe3+,但不一定含有Cu2+;②若剩余的固体为铁和铜的混合物,则反应后的溶液中的阳离子只有Fe2+,一定不含 Fe3+、Cu2+。
(4)高铁酸钾(K2FeO4)中Fe的化合价是+6价,具有强氧化性,能杀菌消毒,其还原产物Fe3+水解生成氢氧化铁胶体,能吸附水中杂质,所以高铁酸钾作为水处理剂发挥的作用是净水、消毒。FeO42- 和H2O反应的离子方程式为4FeO4- +10H2O![]() 4Fe(OH)3+ 8OH- + 3O2↑。
4Fe(OH)3+ 8OH- + 3O2↑。


科目:高中化学 来源: 题型:
【题目】在已达到电离平衡的1 mol·L-1的醋酸溶液中,欲使醋酸电离程度增大,同时使溶液的pH 增大,应采取的措施是( )
A. 通入少量HCl气体 B. 加热
C. 加少量醋酸钠晶体 D. 加少量水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应既属于氧化还原反应,又属于放热反应的是
A.灼热的碳与二氧化碳的反应 B.盐酸与烧碱溶液的反应。
C.乙醇在空气中的燃烧 D.氢氧化钡晶体与氯化铵晶体在常温下的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.25℃、101 kPa时,0.1NA个H2分子完全燃烧生成气态水,放出a kJ热量,表示氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)= H2O(g) ΔH=-10a kJ·mol-1
O2(g)= H2O(g) ΔH=-10a kJ·mol-1
B.500℃、30 MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1。将分子数为1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3 kJ
2NH3(g) ΔH=-38.6kJ·mol-1。将分子数为1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3 kJ
C.在反应KClO3 +6HCl = KCl+3Cl2↑+3H2O中,每生成3 mol Cl2转移的电子数为5NA
D.以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极生成的H2在标准状况下体积为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于气体制备的说法不正确的是( )
A.用碳酸钠粉末可以制备CO2
B.用铁片和稀H2SO4反应制取H2时,为加快产生H2的速率可改用浓H2SO4
C.加热分解NH4HCO3固体,将所得的气体进行适当处理可获得NH3
D.用KMnO4固体和用KClO3固体制备O2的装置完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶溶液只含Cl-、CO![]() 、SO
、SO![]() 、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
、Na+、Mg2+、Cu2+六种离子中的某几种.通过实验:
①原溶液![]() 白色沉淀;
白色沉淀;
②原溶液中加BaCl2溶液不产生沉淀;
③原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解,回答下列问题:
(1)试分析原溶液中一定含有的离子是________,一定不含有的离子是________,可能含有的离子是________。
(2)有的同学认为实验③可以省略,你认为是否正确(填“是”或“否”)________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是

A.反应的化学方程式为:2 M![]() N
N
B.t1时,N的浓度是M浓度的2倍
C.t2时,正逆反应速率相等,达到平衡
D.t3时,正反应速率大于逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
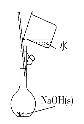
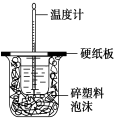
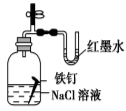
【题目】观察下列有关实验装置,相关评价错误的是( )

图(1) 图(2) 图(3) 图(4)
A.图(1)用于配制0.10 mol·L-1 NaOH溶液;评价:正确
B.图(2)用于测定中和热;评价:错误,装置中缺少了环形玻璃搅拌棒
C.图(3)用于比较Na2CO3、NaHCO3的热稳定性;评价:正确
D.图(4)证明铁发生吸氧腐蚀时空气参加反应;评价:正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com