
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】实施以节约能源和减少废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。试运用所学知识,回答下列问题:
Ⅰ.已知反应:①CH4(g)+H2O (g) ![]() CO(g)+3H2(g) ΔH=+206 kJ·mol-1
CO(g)+3H2(g) ΔH=+206 kJ·mol-1
②C(s)+H2O (g) ![]() CO(g)+ H2(g) ΔH=+131 kJ·mol-1
CO(g)+ H2(g) ΔH=+131 kJ·mol-1
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。CH4(g) ![]() C(s)+2H2(g) ΔH=________kJ·mol-1。
C(s)+2H2(g) ΔH=________kJ·mol-1。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1; c(H2O)=5.0 mol·L-1;c (CO)=1.5 mol·L-1;c(H2)=2.0 mol·L-1,则此时该可逆反应的状态是_______(填序号)
a.达到平衡 b.向正反应方向移动 c.向逆反应方向移动
Ⅱ.甲醇是一种可再生能源,工业上用CO与H2来合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g),回答下列问题:
CH3OH(g),回答下列问题:
(1)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,平衡时,下列说法正确的是_______。
A.v(H2)正=v(CH3OH)逆 B.2v(CO)=v(H2)
C.CO与H2转化率相等 D.CO与H2的物质的量之比不再改变
(2)图是该反应在不同温度下CO的转化率随时间变化的曲线。温度T1和T2大小关系是T1____T2(填“>”、“<”或“=”),对应温度的平衡常数大小关系是K1____K2(填“>”、“<”或“=”)。
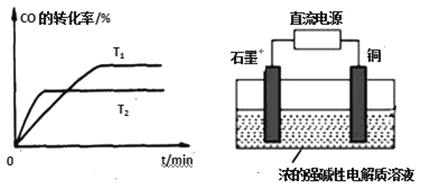
(3)用甲醇燃料电池作为直流电源,设计如图2装置制取Cu2O,写出铜电极的电极反应式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
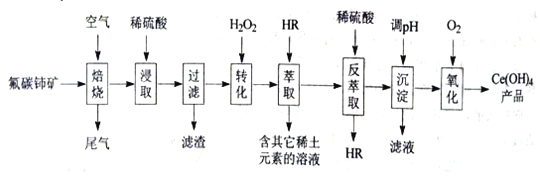
【题目】稀土元素包括钪、亿和系共17种元素,是重要的战略资源,我国稀土资源丰富。从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的一种工艺流程如图:
已知:①焙烧后铈元素主要以CeO2形式存在,Ce(
OH)3的Ksp=10×10-20
②Ce4+能与SO42-结合成[CeSO4]2+,Ce3+能被萃取剂HR萃取
(1)为提高原料的利用率,焙烧前应将矿石____处理。
(2)“浸取”过程中铈元素发生反应的离子方程式为___。
(3)“转化”过程中H2O2的作用是___。
(4)“萃取”过程中发生反应:Ce3+(水层)+3HR(有机层)CeR3(有机层)+3H+(水层)设计“萃取”和“反萃取”操作的目的是___;HR应该具有的特点是____。
a.萃取剂HR的密度一定比水大
b.萃取剂HR不溶于水,也不和水反应
c.萃取剂HR和Ce3+不反应
d.Ce3+在萃取剂中溶解度大于水中
(5)“调节pH”时,为了使Ce3+完全沉淀(浓度小于1×10-5mol/L),溶液的pH应大于___。
(6)“氧化”操作得到产品的化学方程式为____。
(7)CeO2是汽车尾气净化器中的关键催化剂,能在还原性气氛中供氧,在氧化性气氛中耗氧,过程为:2CeO22CeO2-x+xO2↑(0≤x≤0.5)。写出CeO2消除CO的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙、丙三位同学分别设计如下三个实验方案:
甲:向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成则可证明发生了消去反应。
乙:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
丙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应。
其中正确的是( )
A. 甲 B. 乙 C. 丙 D. 上述实验方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
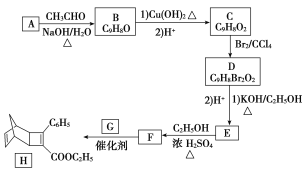
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
已知:①RCHO+CH3CHO![]() RCH===CHCHO+H2O;②||+
RCH===CHCHO+H2O;②||+![]()
![]() 。
。
回答下列问题:
(1)A的化学名称是________。
(2)由C生成D和E生成F的反应类型分别是________、________。
(3)E的结构简式为_________________________________。
(4)由B 生成C加入氢氧化铜,加热反应的化学方程式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在密闭容器反应,达到平衡状态的标志是()
2NO+O2在密闭容器反应,达到平衡状态的标志是()
(1)单位时间内生成n mol O2的同时生成2n mol NO2
(2)单位时间内生成n mol O2的同时生成2n mol NO
(3)用NO2、NO、O2的物质的量浓度变化表示反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的平均相对分子质量不再改变的状态.
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 、
、![]() 、Z-、W2四种离子均具有相同的电子层结构
、Z-、W2四种离子均具有相同的电子层结构![]() 下列关于X、Y、Z、W四种元素的描述,不正确的是
下列关于X、Y、Z、W四种元素的描述,不正确的是![]()
![]()
A.原子序数:Y>X>Z>WB.离子半径:X+>Y2+>Z->W2-
C.原子最外层电子数:Z>W>Y>XD.还原性:X>Y>W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.235g核素![]() U发生裂变反应:
U发生裂变反应:![]() +
+![]()
![]()
![]() Sr+
Sr+![]() Xe+10
Xe+10![]() ,净产生的中子(
,净产生的中子(![]() )数为10NA
)数为10NA
B.![]() Cl与
Cl与![]() Cl得电子能力相同
Cl得电子能力相同
C.中子数为146、质子数为92的铀(U)原子:![]() U
U
D.![]() U和
U和![]() U是中子数不同,质子数相同的同种核素
U是中子数不同,质子数相同的同种核素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国由海水提取的食盐(海盐)不足四成,大部分产自内陆盐湖(湖盐)和盐矿(矿盐)。
(1)由内陆盐湖水为原料进行晒盐,有“夏天采盐(食盐)、冬天捞硝(芒硝)”的说法,下列对其化学原理的描述正确的是___(选填编号)。
a.由夏到冬,芒硝的溶解度变小
b.由冬到夏,氯化钠的溶解度变小
c.夏天温度高,氯化钠易结晶析出
(2)芒硝型矿盐卤水中含有一定量Na2SO4和少量Ca2+、Mg2+、H2S等杂质,利用硫酸钙微溶于水的性质,用石灰-烟道气(CO2)法净化芒硝型矿盐卤水的流程如图:
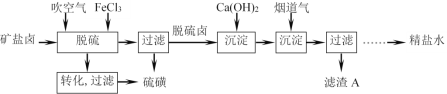
脱硫工序中先吹空气,发生物理和化学变化:物理变化是氢硫酸有挥发性,部分被直接吹出,化学变化是___(用化学方程式表示)。再加入稍过量的FeCl3溶液除去残留的硫化氢。检验FeCl3已经过量的试剂是___(填写化学式)。
(3)加入Ca(OH)2能降低芒硝浓度并生成烧碱,同时除去Fe3+,另一目的是___。滤渣A的主要成分除了Fe(OH)3外,还有___(填写化学式)。
(4)如图所示是石灰-纯碱法净化芒硝型矿盐卤水的部分流程:加入纯碱的作用是___(选填编号)。
a.调节溶液的pH b.除去溶液中的Ca2+
c.除去溶液中的Mg2+ d.除去溶液中的SO42―
石灰-烟道气法与石灰-纯碱法相比较,石灰-烟道气法的优点是___。

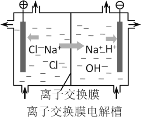
(5)如图是离子交换膜法电解食盐水的示意图,离子交换膜只允许阳离子通过,上述精盐水需要进行二次精制后才能作为离子交换膜电解槽的原料。对盐水进行二次精制的目的是___(选填编号)。
a.进一步降低Ca2+、Mg2+的浓度,提高烧碱纯度
b.进一步降低SO42―的浓度,提高烧碱纯度
c.防止杂质离子与碱生成的沉淀堵塞离子交换膜
d.防止溶液酸性或碱性过强,腐蚀离子交换膜
盐水中硫酸根浓度过高会使生成的氯气中混有氧气,检验氯气中是否含有少量氧气的操作是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com