
【题目】稀土元素包括钪、亿和系共17种元素,是重要的战略资源,我国稀土资源丰富。从氟碳铈矿(主要化学成分为CeFCO3)提取铈族稀土元素的一种工艺流程如图:
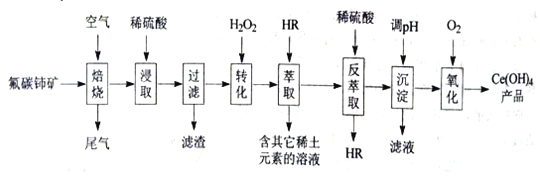
已知:①焙烧后铈元素主要以CeO2形式存在,Ce(
OH)3的Ksp=10×10-20
②Ce4+能与SO42-结合成[CeSO4]2+,Ce3+能被萃取剂HR萃取
(1)为提高原料的利用率,焙烧前应将矿石____处理。
(2)“浸取”过程中铈元素发生反应的离子方程式为___。
(3)“转化”过程中H2O2的作用是___。
(4)“萃取”过程中发生反应:Ce3+(水层)+3HR(有机层)CeR3(有机层)+3H+(水层)设计“萃取”和“反萃取”操作的目的是___;HR应该具有的特点是____。
a.萃取剂HR的密度一定比水大
b.萃取剂HR不溶于水,也不和水反应
c.萃取剂HR和Ce3+不反应
d.Ce3+在萃取剂中溶解度大于水中
(5)“调节pH”时,为了使Ce3+完全沉淀(浓度小于1×10-5mol/L),溶液的pH应大于___。
(6)“氧化”操作得到产品的化学方程式为____。
(7)CeO2是汽车尾气净化器中的关键催化剂,能在还原性气氛中供氧,在氧化性气氛中耗氧,过程为:2CeO22CeO2-x+xO2↑(0≤x≤0.5)。写出CeO2消除CO的化学方程式____。
【答案】粉碎 CeO2+4H++SO42-=[CeSO4]2++2H2O 作还原剂 进一步分离、富集Ce3+ bd 9 2H2O+4Ce(
OH)
3+O2=4Ce(OH)4 2xCO+CeO2=CeO2(1-x)+2xCO2
【解析】
由流程可知,焙烧前粉碎固体可增大接触面积,焙烧后铈元素主要以CeO2形式存在,加硫酸溶解后,过滤加过氧化氢发生2[CeSO4]2++2H2O2=2Ce3++2H2O+O2↑+2SO42-,Ce3+能被萃取剂HR萃取,通过“萃取”与“反萃取进一步分离、富集Ce3+,调节pH生成Ce(OH)3,最后氧化生成Ce(OH)4,以此来解答。
(1)为提高原料的利用率,焙烧前应将矿石粉碎处理,故答案为:粉碎;
(2)“浸取”过程中铈元素发生反应的离子方程式为CeO2+4H++SO42-=[CeSO4]2++2H2O,故答案为:CeO2+4H++SO42-=[CeSO4]2++2H2O;
(3)“转化”过程中H2O2的作用是作还原剂,故答案为:作还原剂;
(4)“萃取”过程中发生反应:Ce3+(水层)+3HR(有机层)CeR3(有机层)+3H+(水层)设计“萃取”和“反萃取”操作的目的是进一步分离、富集Ce3+;HR应该具有的特点是萃取剂HR不溶于水,也不和水反应、Ce3+在萃取剂中溶解度大于水中,故答案为:进一步分离、富集Ce3+;bd;
(5)“调节pH”时,为了使Ce3+完全沉淀(浓度小于1×10-5mol/L),Ce(OH)3的Ksp=1.0×10-20,c(OH-)=3![]() =1×10-5mol/L,溶液的pH应大于9,故答案为:9;
=1×10-5mol/L,溶液的pH应大于9,故答案为:9;
(6)“氧化”操作得到产品的化学方程式为2H2O+4Ce(OH)3+O2=4Ce(OH)4,
故答案为:2H2O+4Ce(OH)3+O2=4Ce(OH)4;
(7)一氧化碳和氧气反应生成二氧化碳,①2CO+O2=2CO2,在氧化气氛中耗氧在尾气消除过程中发生着②CeO2CeO2(1-x)+xO2↑(0≤x≤0.25)的循环,两式合并,①×x+②×2得到CeO2消除CO尾气的化学方程式为2xCO+CeO2=CeO2(1-x)+2xCO2,故答案为:2xCO+CeO2=CeO2(1-x)+2xCO2。


科目:高中化学 来源: 题型:
【题目】100mL 0.3mol·L-1 Na2SO4溶液和50mL 0.2mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为(假设混合前后溶液体积变化忽略不计)( )
A.0.20mol·L-1B.0.25mol·L-1C.0.40mol·L-1D.0.50mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
Si(s)+4HCl(g) △H=+Q kJ/mol(Q>0),等温、恒压条件下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若充入与反应无关的气体,由于保持压强不变,则反应速率不变
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为Q kJ
C.当反应吸收热量为0.025Q kJ时,生成的HCl通入100mL1mol/L的NaOH溶液恰好完全反应
D.反应至4min时,若HCl浓度为0.12mol/L,则0~4min内H2的反应速率为0.03moL/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是化学必修2第64页配图(氢原子已省略),请根据下图回答有关问题;
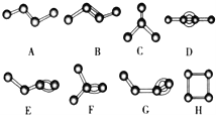
(1)属于烯烃类的有 ________(填编号);
(2)写出化合物B的结构简式 _________,H的分子式 ___________;
(3)指出上图有机化合物中官能团的名称 _______________
(4)A和C的关系是 ______________
(5)D与G的关系是 ___________________
(6)有机物种类繁多的原因有 ________________________(至少答两种原因)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A.1 mol Cl2全部作为氧化剂时,失去的电子数为2NA个
B.在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C.25 ℃,1.01×105 Pa,64 g SO2中含有的原子数为3 NA个
D.NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知(b)![]() 、(d)
、(d)![]() 、(p)
、(p)![]() 的分子式均为C6H6,下列说法正确的是
的分子式均为C6H6,下列说法正确的是
A. b的同分异构体只有d和p两种B. b、d、p的二氯代物均只有三种
C. b、d、p均可与酸性高锰酸钾溶液反应D. b、d、p中只有b的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:
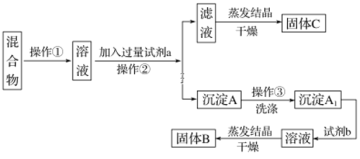
供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是______,操作②的名称是_________。
(2)试剂a是________(填化学式,下同),试剂b是_______,固体B是________。
(3)加入试剂a所发生反应的化学方程式为_______。加入试剂b所发生反应的离子方程式为______。
(4)该方案能否达到实验目的:_____(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)___。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组性质比较中,正确的是()
①沸点:![]()
②离子还原性:![]()
③酸性:![]()
④金属性:![]()
⑤气态氢化物稳定性:![]()
⑥半径:![]()
A.①②③B.③④⑤⑥C.②③④D.①③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关SO2的性质的探究实验报告记录的实验现象正确的是
实验 |
| ||||
记录 | A | 无色 | 无色 | 无色溶液 | 无色溶液 |
B | 红色 | 无色 | 白色沉淀 | 白色沉淀 | |
C | 红色 | 无色 | 白色沉淀 | 无色溶液 | |
D | 无色 | 无色 | 无色溶液 | 无色溶液 | |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com