
| A. | 酸性:HIO4>HBrO4>HClO4 | B. | 原子半径:Na>Cl>S | ||
| C. | 碱性:KOH>NaOH>LiOH | D. | 金属性:Na>Al>Mg |
分析 A.根据元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强;B.根据同周期元素的半径从左至右逐渐减小以及一般来说下一周期元素原子的半径比上一周期大;C.元素的金属性越强,其最高价氧化物对应水化物的碱性越强;D.同一周期,随着原子序数的递增,金属性减弱.
解答 解:A.因元素的非金属性越强其对应的最高价氧化物对应的水化物的酸性越强,非金属性:Cl>Br>I,
酸性:HClO4>HBrO4>HIO4,故A错误;B.根据同周期元素的半径从左至右逐渐减小得知,原子半径Na>S>Cl,故B错误;C.由于金属性K>Na>Li,所以碱性:OH>NaOH>LiOH,故C正确;D.由于原子序数Al>Mg>Na,所以金属性Na>Mg>Al,故D错误,故选C.
点评 本题考查元素周期律,为高频考点,明确同一主族、同一周期原子结构与元素周期律的关系是解本题关键,注意规律中的反常现象.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 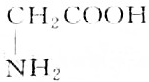 | B. | 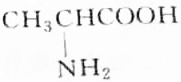 | ||
| C. | 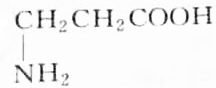 | D. | 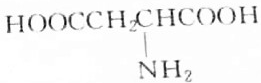 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍、镁、钙、锶、钡等碱土金属元素,在自然界都以化合态存在 | |
| B. | 从元素周期表知道,现在已经发现了113种原子 | |
| C. | 室温时,0族元素的单质都是气体 | |
| D. | 第三周期的主族元素原子的最高正价数与原子最外层电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pb是正极 | B. | PbO2得电子,被氧化 | ||
| C. | 负极反应是:Pb-2e-+SO42-=PbSO4 | D. | 电池放电时,溶液酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

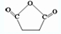 .
. )外的名称是酯基,C→D的反应类型为取代反应.
)外的名称是酯基,C→D的反应类型为取代反应. (任写一个).
(任写一个).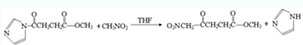 .
. ,请根据本题的所有信息设计由CH3CH2COOH、苯为原料合成单体
,请根据本题的所有信息设计由CH3CH2COOH、苯为原料合成单体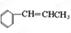 的合成路线流程图(无机试剂任选)
的合成路线流程图(无机试剂任选)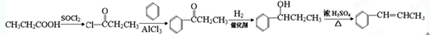 .合成路线流程图示例如下:HC2=CH2$\stackrel{HBr}{→}$CH3CH2$→_{△}^{NaOH溶液}$CH3CH2OH.
.合成路线流程图示例如下:HC2=CH2$\stackrel{HBr}{→}$CH3CH2$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com