
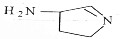
 ,则分子中σ键与π键之比为14:1.
,则分子中σ键与π键之比为14:1.  阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 单质与同浓度稀盐酸反应的速率为L<M | |
| B. | R与T形成的化合物一定能使品红溶液褪色 | |
| C. | 氢化物的稳定性为:H2T>H2R | |
| D. | 当单质L着火时,可用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HIO4>HBrO4>HClO4 | B. | 原子半径:Na>Cl>S | ||
| C. | 碱性:KOH>NaOH>LiOH | D. | 金属性:Na>Al>Mg |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高反应体系的温度,可使反应速率变大 | |
| B. | 该反应中N2不可能100%转化为NH3 | |
| C. | 该反应达到平衡状态时,N2、H2和NH3三者的浓度一定相等 | |
| D. | 为了提高H2的转化率,可适当提高N2的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
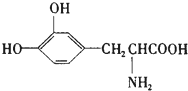 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )| A. | 只能与碱反应,不能与酸反应 | |
| B. | 1mol该物质最多与4molNaOH反应 | |
| C. | 该物质不能使酸性KMnO4褪色 | |
| D. | 1mol该物质最多可与1.5molHBr反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
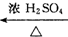 A(C4H8O3)$→_{△}^{浓H_{2}SO_{4}}$乙,甲、乙的分子式都为C4H6O2,甲能使溴的四氯化碳溶液褪色,乙为五元环状化合物,则甲不能发生的反应类型有( )
A(C4H8O3)$→_{△}^{浓H_{2}SO_{4}}$乙,甲、乙的分子式都为C4H6O2,甲能使溴的四氯化碳溶液褪色,乙为五元环状化合物,则甲不能发生的反应类型有( )| A. | 消去反应 | B. | 酯化反应 | C. | 加聚反应 | D. | 氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
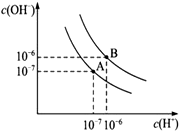 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com