
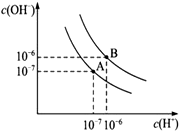
 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:分析 (1)横轴是氢离子浓度,纵轴是氢氧根离子浓度,水的离子积常数Kw=c(H+)×c(OH-)计算出A曲线的Kw,然后结合水的电离过程吸热判断25℃时水的电离平衡曲线;
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)设出酸溶液的pH为a,碱溶液的pH为b,根据该温度以及体积关系列式计算;
(4)根据曲线B对应温度下pH=5,说明溶液显示酸性,反应后氢离子过量分析;
(5)根据0.1L 0.1mo/L的NaA溶液的pH=10判断盐的类型;
(6)根据溶解度和密度计算氢氧化钙的物质的量浓度,根据氢氧化钙和钙离子、氢氧根离子之间的关系式计算钙离子浓度、氢氧根离子浓度,再结合离子积常数公式计算离子积.
解答 解:(1)曲线A条件下Kw=c(H+)×c(OH-)=10-7×10-7=10-14,曲线B条件下c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+)•c(OH-)=10-12;水的电离时吸热过程,加热促进电离,所以A曲线代表25℃时水的电离平衡曲线,故答案为:A;水的电离是吸热过程,温度低时,水的电离程度小,c(H+)、c(OH-)小;
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)•10-5 mol•L-1=V(H2SO4)•10-4 mol•L-1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(3)设强酸溶液的pH为a,体积为100V,溶液中氢离子浓度为:10-amol/L;碱溶液的pH为b,体积为V,溶液中氢氧根离子的浓度为:10-(12-b)mol/L,
混合后溶液呈中性,则满足溶液中氢离子的物质的量大于氢氧根离子的物质的量,即10-amol/L×100VL=10-(12-b)mol/L×VL,
解得:2-a=b-12,a+b=14,即pH1+pH2=14,
故答案为:pH1+pH2=14;
(4)在曲线B对应温度下,因pH(酸)+pH(碱)=12,可得酸碱两溶液中c(H+)=c(OH-),如是强酸碱,两溶液等体积混合后溶液呈中性;现混合溶液的pH=5,即等体积混合后溶液显酸性,说明H+与OH-完全反应后又有新的H+产生,酸过量,所以酸HA是弱酸,
故答案为:曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5;
(5)由于0.1L 0.1mo/L的NaA溶液的pH=10,说明溶液显示碱性,属于强碱弱酸盐,故不水解的钠离子浓度大于A-离子浓度,溶液显碱性,氢离子浓度大于氢氧根离子浓度,故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(6)若某温度下Ca(OH)2的溶解度为0.74g,设饱和溶液的密度为1g/mL,则100g水中溶解0.74g氢氧化钙时氢氧化钙的C=$\frac{\frac{0.74g}{74g/mol}}{\frac{100g+0.74g}{1g/mL×1{0}^{-3}}}$≈0.1mol/L,氢氧化钙是强电解质,所以c(Ca(OH)2)=c(Ca2+ )=0.1mol/L,c(OH-)=2c(Ca(OH)2)=0.2mol/L,离子积=[c(Am+)]n[c(Bn-)]m=c(Ca2+ ).c(OH-)2=0.1mol/L×(0.2mol/L)2=4×10-3(mol/L)3,
故答案为:4×10-3.
点评 本题考查水的电离和酸、碱混合的pH计算问题,难度较大,注意温度不同而使水的离子积常数不同是解本题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 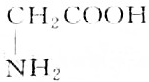 | B. | 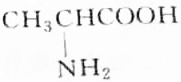 | ||
| C. | 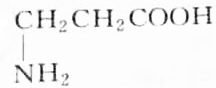 | D. | 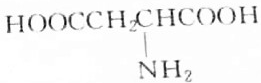 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

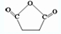 .
. )外的名称是酯基,C→D的反应类型为取代反应.
)外的名称是酯基,C→D的反应类型为取代反应. (任写一个).
(任写一个).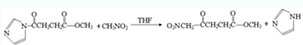 .
. ,请根据本题的所有信息设计由CH3CH2COOH、苯为原料合成单体
,请根据本题的所有信息设计由CH3CH2COOH、苯为原料合成单体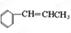 的合成路线流程图(无机试剂任选)
的合成路线流程图(无机试剂任选)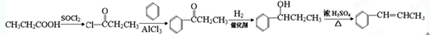 .合成路线流程图示例如下:HC2=CH2$\stackrel{HBr}{→}$CH3CH2$→_{△}^{NaOH溶液}$CH3CH2OH.
.合成路线流程图示例如下:HC2=CH2$\stackrel{HBr}{→}$CH3CH2$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


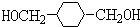 .
.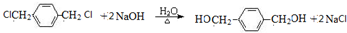 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
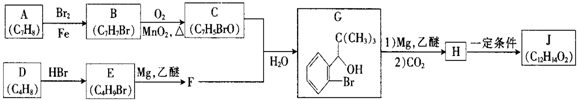
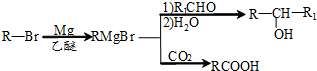
 (写明反应条件).
(写明反应条件).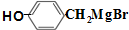 与CO2反应生成X,X的同分异构体中:
与CO2反应生成X,X的同分异构体中: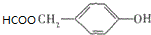 .
.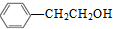 )的路线流程图(其它试剂任选).合成路线流程图表达方法例如下:
)的路线流程图(其它试剂任选).合成路线流程图表达方法例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素特征信息 |
| A | 其单质是密度最小的物质 |
| B | 其阴离子带两个单位负电荷,单质是空气的主要成分之一 |
| C | 其阳离子与B的阴离子有相同的电子层结构,且与B可以形成两种离子化合物 |
| D | 其氢氧化物和氧化物都有两性,与C同周期 |
| E | 与C同周期,原子半径在该周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A组 | B组 |
| Ⅰ.H2O分子间存在氢键,H2S则无 | ①H2O比H2S稳定 |
| Ⅱ.晶格能NaI比NaCl小 | ②NaCl比NaI熔点低 |
| Ⅲ.晶体类型不同 | ③N2分子比磷的单质稳定 |
| Ⅳ.元素第一电离能大小与原子外围电子排布有关,不一定像电负性随原子序数递增而增大 | ④同周期元素第一电离能大的,电负性不一定大 |
| A. | Ⅰ① | B. | Ⅱ② | C. | Ⅲ③ | D. | Ⅳ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com