
【题目】第24届冬季奥林匹克运动会将于2022在北京召开,体现现代体育赛事公平性的一个重要方式就是坚决反对运动员服用兴奋剂。以下是两种兴奋剂结构简式:
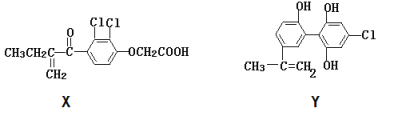
回答下列问题:
(1)X不能发生的反应类型为___(选填字母序号)。
A.加成反应 B.取代反应 C.消去反应 D.加聚反应
(2)1molX与足量的NaOH溶液反应,最多消耗__molNaOH。
(3)Y最多有__个碳原子共平面。
(4)1molX与足量的H2在一定条件下反应,最多能消耗氢气为__mol。
(5)Y与足量的浓溴水反应的方程式为:___。
【答案】C 5 15 5 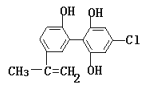 +4Br2
+4Br2![]()
 +3HBr
+3HBr
【解析】
(1) 根据有机物结构中的官能团性质分析可能发生的反应类型;(2) 根据卤代烃的性质及羧基的性质分析反应中消耗氢氧化钠的物质的量;(3) 根据苯环及乙烯的结构特点运用类比迁移的方法分析有机物中共面问题;(4) 根据加成反应原理分析加成反应中消耗氢气的物质的量;(5) 根据苯酚的性质及烯烃的性质分析书写相关反应方程式。
(1) 由X的结构分析,分子中含有碳碳双键,则可以发生加成反应和加聚反应,结构中还含有羧基,则可以发生酯化反应,即取代反应,苯环上含有氯原子,但与氯连接的相邻碳原子上没有氢原子,不能发生取代反应,故答案为:C;
(2) 1molX中含有2molCl原子和1mol羧基,卤代烃水解生成酚和氢氧化钠发生中和反应,所以最多消耗5molNaOH,故答案为:5;
(3) 碳碳单键可以旋转,则Y中两个苯环可以在一个平面上,根据乙烯的平面结构分析,![]() 中三个碳原子也可以与苯环共面,则Y中最多有15个碳原子共平面,故答案为:15;
中三个碳原子也可以与苯环共面,则Y中最多有15个碳原子共平面,故答案为:15;
(4) X中含有1个苯环,1个碳碳双键,1个羰基,则1molX与足量的H2在一定条件下反应,最多能消耗氢气为3+1+1=5mol,故答案为:5;
(5) Y中含有3个酚羟基,且共有3个邻位H原子可被取代,另含有C=C,可与溴水发生加成反应,则1molX 与足量浓溴水反应,最多消耗4molBr2,反应方程式为: +4Br2
+4Br2![]()
 +3HBr,故答案为:
+3HBr,故答案为: +4Br2
+4Br2![]()
 +3HBr。
+3HBr。


科目:高中化学 来源: 题型:
【题目】某酸HA是一元弱酸,25℃时的电离平衡常数Ka=4.0×10-8。
(1)写出该酸的电离方程式___,其电离平衡常数表达式Ka=____。
(2)25℃时,向1mol·L-1HA溶液中加入1 mol·L-1 盐酸,会____(“抑制”或“促进”)HA的电离,c(H+)____(填“增大”、“减小”或“不变”), 电离平衡常数Ka___(填“增大”、“减小”或“不变”)。
(3)25℃时,若HA的起始浓度为0.01mol·L-1,则平衡时c(H+)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示转化关系(X代表卤素),说法不正确的是

A.2H(g) +2X(g) == 2HX(g) ΔH3<0
B.途径Ⅰ生成HX的反应热与途径无关,所以ΔH1 = ΔH2 + ΔH3
C.Cl、Br、I的非金属性依次减弱,所以途径Ⅱ吸收的热量依次增多
D.途径Ⅰ生成HCl放出的热量比生成HBr的多,说明HCl比HBr稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,一定条件下发生化学反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反应时 NO和CO各为 4 mol,10 秒钟后达到化学平衡,测得N2为1 mol。下列有关反应速率的说法中,正确的是( )
A. 反应前5秒钟内,用NO表示的平均反应速率为0.lmol·L-1·s-1
B. 达到平衡后,升髙温度,正反应速率将减小,逆反应速率将增大
C. 达到平衡后,反应速率的关系有:V正(CO)=2v逆(N2)
D. 保持容器体积不变,往容器中充入1 mol O2,正、逆反应速率都不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol两种气态烃组成的混合气完全燃烧后得到6.72L二氧化碳(标准状况下)和7.2g水,下列关于该混合烃说法正确的是( )
A.一定有乙烯B.一定有甲烷
C.一定是甲烷和乙烯的混合气体D.可能有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图装置也可用于检验溴乙烷与氢氧化钠的醇溶液反应生成物乙烯的检验,下列说法不正确的是
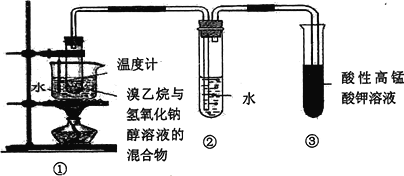
A. 该反应为消去反应 B. 反应实验过程中可观察到酸性KMnO4溶液褪色
C. 可用溴水溶液代替酸性KMnO4溶液 D. 乙烯难溶于水,故此装置②可以省去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二氮是白色固体,熔点为30℃,升温时易液化和气化,并发生以下两个相互联系的反应:①N2O5(g)![]() N2O3(g)+O2(g)②N2O3(g)
N2O3(g)+O2(g)②N2O3(g)![]() N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
N2O(g)+O2(g)在0.5L密闭容器中,将2.5molN2O5加热气化,并按上述①②两式分解,在某温度下达到平衡,测得O2的平衡浓度为4.4mol/L,N2O3的平衡浓度1.6mol/L,则下列各项判断正确的是( )
A.N2O5的转化率为60%
B.平衡时N2O3的物质的量为0.7mol
C.N2O5的平衡浓度为3.0mol/L
D.N2O的平衡浓度为4.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)是一种重要的有机化工原料,为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
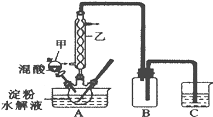
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,然后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是__。
(2)如何检验该装置的气密性:__。
(3)要控制反应温度55~60℃,应选择加热的方式是__,C装置中应加入__溶液。
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:___。
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | |||
实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
由此你认为溶液褪色总是先慢后快的原因是__。
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液放入锥形瓶中,将0.10mol/L酸性KMnO4溶液装在__(填仪器名称)中进行滴定,达到滴定终点时的现象是__。若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关晶体的叙述中不正确的是( )
A.金刚石的网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围距离相等的Na+离子共有6个
C.氯化铯晶体中,每个铯原子周围紧邻8个氯原子
D.干冰晶体中,每个二氧化碳分子周围紧邻12个二氧化碳分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com