
分析 (1)二氧化硫和氮氧化物是形成酸雨的主要气体;
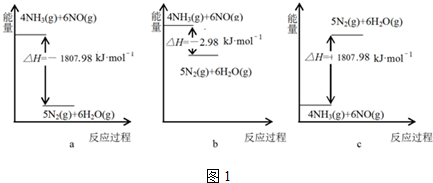
(2)①①N2(g)+O2(g)?2NO(g)△H=+180.50kJ•mol-1
②4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.48kJ•mol-1
根据盖斯定律,①×5+②得到:4NH3(g)+6NO(g)=5N2(g)+6H2O(g);
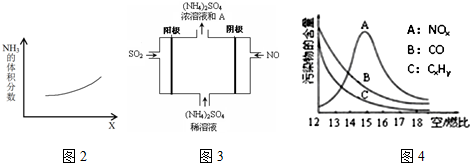
②该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动;
(3)①NO得电子生成铵根;
②SO2失电子形成硫酸;
(4)①燃油气燃烧更充分;
②反应 N2(g)+O2(g)?2NO(g) 是吸热反应.
解答 解:(1)二氧化硫和氮氧化物是形成酸雨的主要气体,故答案为:SO2 和 NOX;
(2)①已知①N2(g)+O2(g)=2NO(g);△H=180.50kJ•mol-l
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905.48kJ•mol-l
氨气被一氧化氮氧化生成氮气和气态水的热化学方程式依据盖斯定律,结合热化学方程式合并计算:①×5+②得到:
4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H=-1807.98kJ/mol,
故答案为:a;
②,该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动,使NH3的体积分数增大,故答案为:温度或压强;因为该反应是放热及体积增大的可逆反应,升高温度或增大压强,平衡均逆向移动,使NH3的体积分数增大;
(3)①NO得电子生成铵根,离子方程式:NO+5e-+6H+=NH4++H2O,故答案为:NO+5e-+6H+=NH4++H2O;
②SO2失电子形成硫酸,反应方程式:5SO2+2NO+8H2O$\frac{\underline{\;通电\;}}{\;}$(NH4)2SO4+4H2SO4,故答案为:H2SO4;根据反应:5SO2+2NO+8H2O$\frac{\underline{\;通电\;}}{\;}$(NH4)2SO4+4H2SO4,产物中除有(NH4)2SO4外还有H2SO4;
(4)①空/燃比增大,燃油气燃烧更充分,故答案为:空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少;
②反应 N2(g)+O2(g)?2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,故答案为:因为反应 N2(g)+O2(g)?2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少.
点评 本题考查了盖斯定律在反应热计算中的应用、电解原理以及燃料的充分燃烧,题目难度中等,注意掌握盖斯定律的概念,试题培养了学生灵活应用所学知识.


科目:高中化学 来源: 题型:选择题
| A. | 都能使溴水和酸性高锰酸钾溶液褪色 | |
| B. | 都能发生加聚反应生成高分子化合物 | |
| C. | 都不溶于水,且密度比水小 | |
| D. | 分子中各原子都处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最易失去的电子能量最高 | |
| B. | L层电子比K层电子能量高 | |
| C. | p轨道电子能量一定高于s轨道电子能量 | |
| D. | 在离核最近区域内运动的电子能量最低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大.第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO3 2-离子数之和为0.1NA | |
| B. | 标准状况下,22.4LC2H4与C3H6混合气体所含有分子数为NA | |
| C. | 1molNa2O2与足量的CO2反应转移的电子数为2NA | |
| D. | 18gNH4+所含的电子数11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.4g乙烯与丙烯的混合气体含有NA个碳原子 | |
| B. | 精炼铜,若阳极失去2NA个电子,则阴极增重64g | |
| C. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| D. | 将1L 2mol/L的FeCl3溶液加入到沸水中,加热使之完全反应,所得氢氧化铁胶体粒子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com