
【题目】“低碳经济”已成为全世界科学家研究的重要课题。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)已知:①CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41 kJ·mol-1
H2(g)+CO2(g) ΔH=-41 kJ·mol-1
②C(s)+2H2(g) ![]() CH4(g) ΔH=-73 kJ·mol-1
CH4(g) ΔH=-73 kJ·mol-1
③2CO(g) ![]() C(s)+CO2(g) ΔH=-171 kJ·mol-1
C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:____
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,在容积为2 L密闭容器中,充入1 mol CO2和3.25 mol H2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化如图所示:
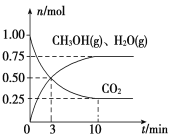
①从反应开始到平衡,氢气的平均反应速率v(H2)=________。
②下列措施一定不能使CO2的平衡转化率增大的是________。
A 在原容器中再充入1 mol CO2
B 在原容器中再充入1 mol H2
C 在原容器中充入1 mol氦气
D 使用更有效的催化剂
E 缩小容器的容积
F 将水蒸气从体系中分离
(3)煤化工通常研究不同条件下CO转化率以解决实际问题。已知在催化剂存在条件下反应:CO(g)+H2O(g) ![]() H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
H2(g)+CO2(g)中CO的平衡转化率随p(H2O)/p(CO)及温度变化关系如图所示:
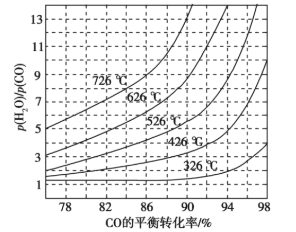
①上述反应的正反应方向是________反应(填“吸热”或“放热”);
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则该反应的Kp=_____(填表达式,不必代数计算);如果提高p(H2O)/p(CO),则Kp_______(填“变大”“变小”或“不变”)。使用铁镁催化剂的实际工业流程中,一般采用400 ℃左右、p(H2O)/p(CO)=3~5,采用此条件的原因可能是_______
(4)科学家用氮化镓材料与铜组装成如图所示的人工光合系统,利用该装置实现了用CO2和H2O合成CH4。下列关于该电池的叙述错误的是________。
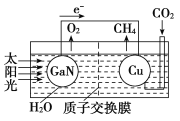
A.该装置能量转化形式仅存在将太阳能转化为电能
B.铜电极为正极,电极反应式为CO2+8e-+8H+===CH4+2H2O
C.电池内部H+透过质子交换膜从左向右移动
【答案】CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1 0.112 5 mol·L-1·min-1 ACD 放热 pCO2pH2/pCOpH2O 不变 催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算 A
CH4(g)+2H2O(g) ΔH=-162 kJ·mol-1 0.112 5 mol·L-1·min-1 ACD 放热 pCO2pH2/pCOpH2O 不变 催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算 A
【解析】
(1)依据热化学方程式和盖斯定律分析计算;
(2)①根据图知,达到平衡状态时n(CH3OH)=n(H2O)=0.75mol,根据H原子守恒得消耗n(H2)=2n(CH3OH)+n(H2O)=2×0.75mol+0.75mol=2.25mol,结合v(H2)=![]() 计算;
计算;
②使CO2的转化率增大须使平衡向正反应方向移动,可采取的措施有增大压强、分离生成物或增加另一种反应物等措施;
(3)①由图可知,在相同的 时,温度越高,CO的转化率越低,据此分析判断;②根据平衡常数的含义结合平衡常数只与温度有关判断;结合投料比、催化剂的活性、经济成本分析解答;
时,温度越高,CO的转化率越低,据此分析判断;②根据平衡常数的含义结合平衡常数只与温度有关判断;结合投料比、催化剂的活性、经济成本分析解答;
(4)该装置中,根据电子流向可知GaN是负极、Cu是正极,负极反应式为:2H2O-4e-=4H++O2↑,正极反应式为:CO2+8e-+8H+=CH4+2H2O,据此分析解答。
(1)①CO(g)+H2O(g)H2(g)+CO2(g)△H=-41kJmol-1,②C(s)+2H2(g)CH4(g)△H=-73kJmol-1,③2CO(g)C(s)+CO2(g)△H=-171kJmol-1,盖斯定律计算②+③-①×2 得到CO2(g)+4H2(g)═CH4(g)+2H2O(g)△H=-162 kJmol-1,故答案为:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=-162 kJmol-1;
CH4(g)+2H2O(g) ΔH=-162 kJmol-1;
(2)①根据图知,达到平衡状态时n(CH3OH)=n(H2O)=0.75mol,根据H原子守恒得消耗n(H2)=2n(CH3OH)+n(H2O)=2×0.75mol+0.75mol=2.25mol,从反应开始到平衡,氢气的平均反应速率v(H2)=![]() =
= =0.1125mol/(Lmin),故答案为:0.1125mol/(Lmin);
=0.1125mol/(Lmin),故答案为:0.1125mol/(Lmin);
②A.在原容器中再充入l mol CO2,平衡正向移动,但是反应消耗的二氧化碳增加量小于加入二氧化碳增加量,所以二氧化碳的转化率减小,故A选;B.在原容器中再充入1mol H2,平衡正向移动,消耗的二氧化碳量增加,则二氧化碳转化率增大,故B不选;C.在原容器中充入l mol氦气,参加反应的各物质的物质的量浓度不变,平衡不移动,则二氧化碳转化率不变,故C选;D.使用更有效的催化剂,增大化学反应速率,但是平衡不移动,则二氧化碳转化率不变,故D选;E.缩小容器的容积,增大压强平衡向气体体积减小的正反应方向移动,二氧化碳转化率增大,故E不选;F.将水蒸气从体系中分离,平衡正向移动,二氧化碳转化率增大,故F不选;不能使CO2的平衡转化率增大的有ACD,故答案为:ACD;
(3)①由图可知,在相同的 时,温度越高,CO的转化率越低,说明升高温度,平衡逆向移动,说明正反应为放热反应,故答案为:放热;
时,温度越高,CO的转化率越低,说明升高温度,平衡逆向移动,说明正反应为放热反应,故答案为:放热;
②对于气相反应,用某组分(B)的平衡压强(pB)代替物质的量浓度也可以表示平衡常数(记作Kp),反应的平衡常数=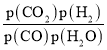 ;平衡常数只与温度有关,与浓度无关,所以提高
;平衡常数只与温度有关,与浓度无关,所以提高 比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高,再增加投料比,需要大大的增加蒸汽添加量,这样在经济上不合算,温度在400℃左右时催化剂的活性最大,所以一般采用400℃左右,
比,则KP不变;由图象可知,投料比太低,CO的转化率不太高,而投料比3~5时转化率已经很高,再增加投料比,需要大大的增加蒸汽添加量,这样在经济上不合算,温度在400℃左右时催化剂的活性最大,所以一般采用400℃左右, =3~5,故答案为:
=3~5,故答案为: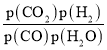 ;不变;催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算;
;不变;催化剂的活性温度在400 ℃左右;投料比太低,CO的平衡转化率不高,而400 ℃左右,投料比3~5时CO的平衡转化率较高,已能满足要求,再增加投料比,成本增大,但CO的平衡转化率提高不多,经济上不合算;
(4) A.根据图示可知,该装置中将太阳能转化为电能和化学能,故A错误;B.根据电子流向可知,Cu是正极,正极上二氧化碳得电子和氢离子反应生成甲烷,电极反应式为:CO2+8e-+8H+=CH4+2H2O,故B正确;C.放电时,电解质溶液中阳离子向正极移动,所以装置中的H+由左向右移动,故C正确;故选A。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】实验室用浓硫酸配制1.0mol/L硫酸溶液480mL,回答下列问题:
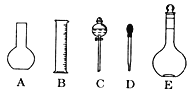
(1)如图所示的仪器中配制溶液肯定不需要的是 ______(填字母),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。
(2)容量瓶上标有以下5项中的_____(填序号)
①压强 ②温度 ③容量 ④浓度 ⑤刻度线
(3)在配制过程中,下列操作使所配溶液浓度偏大的是__________ .
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
③定容时,仰视刻度线
④使用容量瓶前用蒸馏水洗涤且没干燥
(4)计算实验室配制上述溶液需用量筒量取质量分数为98%、密度为1.84g/mL的浓硫酸的体积为:_____mL。(保留小数点后一位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I下面是几种实验中常用的仪器:
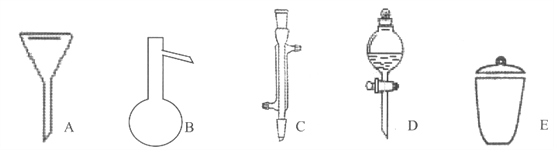
写出序号所代表的仪器的名称:
A__________;B__________;C__________;D__________;E__________
II实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、天平、量筒和__________________。
(2)用托盘天平称取氯化钠固体,其质量为__________g。
(3)下列主要操作步骤的正确顺序是____________________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度__________ (填“偏高”或“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A.H2SO4酸化的KI溶液中加入H2O2:2I-+H2O2+2H+=I2+2H2O
B.SO2通入BaCl2溶液中:SO2+Ba2++H2O=BaSO3↓+2H+
C.(NH4)2Fe(SO4)2溶液中加入少量NaOH溶液:NH4++OH-=NH3·H2O
D.用CuCl2溶液做导电性实验,灯泡发光:CuCl2![]() Cu2++2Cl-
Cu2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
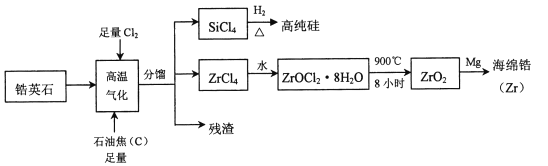
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示
(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. 今有12种物质:①A1 ②稀硝酸 ③H2SO4 ④液氨 ⑤CO2 ⑥空气 ⑦NaCl CaCO3 NaHCO3 酒精![]() Al2O3
Al2O3 ![]() 石墨。以上物质中属于电解质但熔融状态下并不导电的是____________(填序号,下同),属于非电解质的是___________。
石墨。以上物质中属于电解质但熔融状态下并不导电的是____________(填序号,下同),属于非电解质的是___________。
II.按要求填写化学用语:
(1)Na2SO4的电离方程式:_______________________;
(2)Ba(OH)2与CuSO4两稀溶液混合的离子方程式:______________________;
(3)写一个能用Fe3++30H-═Fe(OH)3表示的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G、Q、X、Y、Z均为氯的含氧化合物,我们不了解它们的分子式或化学式,但知道它们在一定条件下具有如下的转换关系(未配平):
(1)G→Q十NaCl (2)Y十NaOH→G十Q十H2O
(3)Q+H2O![]() X+H2 (4)Z十NaOH→Q十X十H2O
X+H2 (4)Z十NaOH→Q十X十H2O
下列有关推断不正确的是( )
A.X一定不是次氯酸盐B.氧化性由弱到强的顺序为GYQZX
C.Z一定不是ClO4-D.G、Q、X、Y、Z均含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
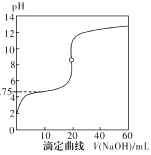
A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
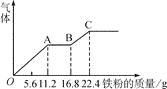
A. 图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为FeSO4
B. 原溶液中H2SO4浓度为2.5 mol·L-1
C. 原混合溶液中NO3-的物质的量为0.2 mol
D. 图中,OA段产生的气体是NO,BC段产生的气体是氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com