
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )
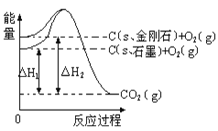
A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
【答案】A
【解析】
由图得:①C(S,石墨)+O2(g)=CO2(g)△H=-393.5kJmol-1
②C(S,金刚石)+O2(g)=CO2(g)△H=-395.4kJmol-1,
利用盖斯定律将①-②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJmol-1
A、因C(s、石墨)=C(s、金刚石)△H=+1.9kJmol-1,A正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,B错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳定,C错误;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJmol-1,1 mol石墨的总键能比1 mol金刚石的总键能大于1.9 kJ,D错误;
选A。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发的对二甲苯绿色合成项目取得新进展,其合成过程如图所示。
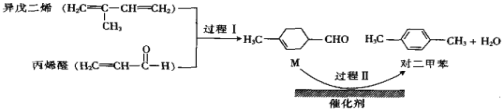
下列说法不正确的是( )
A.M的某种同分异构体含有苯环且能与钠反应放出氢气
B.可用溴水鉴别M和对二甲苯
C.对二甲苯的一氯代物有2种
D.异戊二烯所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
(1)若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是________(填字母)。
A.冷水 B.沸水 C.NaOH浓溶液 D.NaCl浓溶液
(2)现有甲、乙、丙三名同学进行Fe(OH)3胶体的制备:
①甲同学的操作:取一小烧杯,加入25 mL蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液,继续煮沸至混合液呈红褐色,停止加热。请评价该操作是否正确______。
②乙直接加热饱和FeCl3溶液,请评价是否正确______。
③丙向沸水中滴加饱和FeCl3溶液,为了使反应进行充分,煮沸10分钟,请评价是否正确________。
(3)写出制备Fe(OH)3胶体的化学方程式: ____________________。证明有Fe(OH)3胶体生成的实验操作是_____________________。该操作利用胶体的性质是________。
(4)Fe(OH)3胶体稳定存在的主要原因是____________________(填字母,下同)。
A.胶体粒子直径小于1nm B.胶体粒子带正电荷
C.胶体粒子作布朗运动 D.胶体粒子能透过滤纸
(5)Fe(OH)3胶体区别于FeCl3溶液最本质的特征是________。
A.Fe(OH)3胶体粒子的直径在1~100 nm之间
B.Fe(OH)3胶体具有丁达尔效应
C.Fe(OH)3胶体是均一的分散系
D.Fe(OH)3胶体的分散质能透过滤纸
(6)若取少量制得的胶体加入试管中,加入硫酸铵溶液,现象是_____________,这种现象称为胶体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用工业废料(主要成分NiO,含有少量Al2O3、FeO、CuO、BaO)回收NiO,并制备其他部分产品的工艺流程如下:

已知:①溶液中离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
②25℃时,部分难溶物的溶度积常数如下表所示:
难溶物 | CuS | Al(OH)3 | Ni(OH)2 | Fe(OH)3 | Fe(OH)2 |
溶度积常数(Ksp) | 6.3×10-36 | 1.3×10-33 | 2.0×10-15 | 4.0×10-38 | 1.8×10-16 |
请回答下列问题:
(1)H2S的电子式为_______________________________。
(2)“酸浸”时,Ni的浸出率与温度的关系如图所示。 温度高于70℃,Ni的浸出率降低的主要原因为___________________________________________________________。

(3)“沉淀1”的主要成分为____________________(填化学式)。
(4)“滤液1”中通入H2S的作用为___________________。
(5)“转化”过程中,发生反应的主要离子方程式为________________________________。
(6)25℃时,“调节pH2”使沉淀3中金属阳离子沉淀完全后,所得溶液中的C(H+)最大为____________(保留三位有效数字,已知![]() ≈1.4)。
≈1.4)。
(7)“操作I”主要包括蒸发浓缩、__________________、过滤、洗涤、干燥。
(8)NiO可通过铝热反应冶炼Ni,该反应的化学方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A由碳、氢、氧三种元素组成,为研究A的结构,进行了如下实验:称取17.2gA在足量的氧气中燃烧,产物经过足量的浓硫酸后,浓硫酸增重10.8g;再通过足量的碱石灰,碱石灰增重35.2g。质谱图表明A的相对分子质量为86,A可以使溴的四氯化碳溶液褪色,且A能与等物质的量的NaHCO3溶液恰好完全反应,请回答:
(1)A的分子式为________。
(2)若A分子具有支链,则A的结构简式为________;其与NaHCO3溶液反应的化学反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,HCOOH和CH3COOH的电离常数分别1.80×104和1.75×105。将pH=3,体积均为V0的两种酸溶液分别加水稀释至体积V,pH随lg![]() 的变化如图所示。下列叙述错误的是( )
的变化如图所示。下列叙述错误的是( )
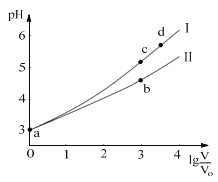
A.溶液中水的电离程度:b点<c点
B.相同体积a点的两溶液分别与NaOH恰好中和后,溶液中n(Na+)相同
C.从c点到d点,溶液中![]() 不变(HA、A-分别代表相应的酸和酸根离子)
不变(HA、A-分别代表相应的酸和酸根离子)
D.若两溶液无限稀释,则它们的c(H+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可以验证非金属性的变化规律。
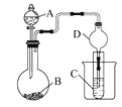
(1)仪器A的名称为________,干燥管D的作用是________________。
(2)已知在常温下,高锰酸钾和浓盐酸反应能生成氯气。实验室中现有药品Na2S溶液、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性大于硫的;装置A、B、C中所装药品分别为________、________、________,装置C中的实验现象为_________________,离子方程式为______。
(3)若要证明非金属性:S>C>Si,则A中加________、B中加Na2CO3、C中加________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-226kJ/mol
O2(g) ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
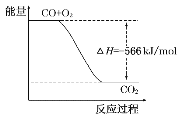
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH=-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com