
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
向一定量的饱和NaOH溶液中加入少量Na2O2固体,恢复到原来温度时,下列说法中正确的是
A.溶液中的Na+总数增大 B.溶液的碱性增强
C.溶质的质量分数不变 D.溶液的质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
“物质结构与性质”模块
请回答下列问题:
(1)31Ga基态原子的核外电子排布式是________________。某种半导体材料由Ga和As两种元素组成,该半导体材料的化学式是________,其晶体结构类型可能为________。
(2)维生素B1可作为辅酶参与糖的代谢,并有保护神经系统的作用。该物质的结构式为
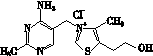
以下关于维生素B1的说法正确的是________。
A.只含σ键和π键
B.既有共价键又有离子键
C.该物质的熔点可能高于NaCl
D.该物质易溶于盐酸
(3)维生素B1晶体溶于水的过程中要克服的微粒间的作用力有________。
A.离子键、共价键
B.离子键、氢键、共价键
C.氢键、范德华力
D.离子键、氢键、范德华力
查看答案和解析>>
科目:高中化学 来源: 题型:
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸 盐、 等化合物的形式存在于地壳中。
盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
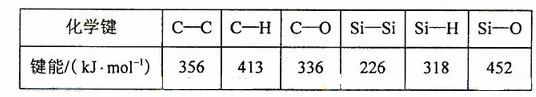
① 硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
② SiH4的稳定性小于CH4,更易生成氧化物,原因是

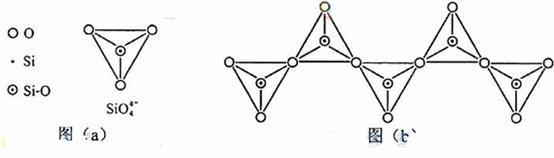
(6)在硅酸盐中, 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为 。Si与O的原子数之比为 化学式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为 。Si与O的原子数之比为 化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是________;
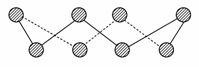
(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为____________________;
(3)Se原子序数为________,其核外M层电子的排布式为________;
(4)H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为________,SO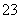 离子的立体构型为________;
离子的立体构型为________;
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:________;
②H2SeO4比H2SeO3酸性强的原因:_______________________
__________________________________________________________;
(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如下图所示,其晶胞边长为540.0 pm,密度为________g·cm-3(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为________pm(列式表示)。
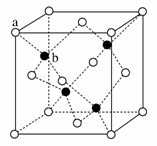
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.含有金属离子的晶体一定是离子晶体
D.元素的非金属型越强,其单质的活泼型一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
在通常条件下,下列各组物质的性质排列正确的是( )
A.熔点:CO2>KCl>SiO2
B.水溶性:HCl>H2S>SO2
C.沸点:乙烷>戊烷>丁烷
D.热稳定性:HF>H2O>NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com