
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。
(2)硅主要以硅酸 盐、 等化合物的形式存在于地壳中。
盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
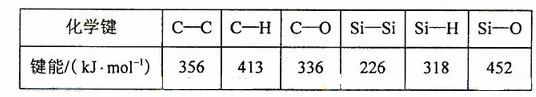
① 硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是
② SiH4的稳定性小于CH4,更易生成氧化物,原因是

(6)在硅酸盐中,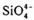 四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为 。Si与O的原子数之比为 化学式为
四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根;其中Si原子的杂化形式为 。Si与O的原子数之比为 化学式为
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
下列有关气体的叙述中,不正确的是
A.不同的气体,若体积不同,则它们所含的分子数肯定不同
B.在标准状况下,气体的摩尔体积约为22.4 L·mol-1
C.当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离
D.气态物质没有固定的形状,且容易被压缩
查看答案和解析>>
科目:高中化学 来源: 题型:
某100 mL物质的量浓度为1 mol/L的NaOH溶液。试计算:
(1) 该溶液中NaOH的质量。
(2) 上述溶液与物质的量浓度为1 mol/L 的HCl溶液恰好完全反应,需HCl溶液的体积是多少毫升?
(3) 该反应后得到溶液中溶质的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——物质结构与性质](13分)
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如下图所示。
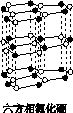
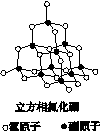
(1)基态硼原子的电子排布式为________。
(2)关于这两种晶体的说法,正确的是________(填序号)。
a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的B—N键均为共价键
d.两种晶体均为分子晶体
(3)六方相氮化硼晶体层内一个硼原子与相邻氮原子构成的空间构型为________,其结构与石墨相似却不导电,原因是_____________________________________________________。
(4)立方相氮化硼晶体中,硼原子的杂化轨道类型为________。该晶体的天然矿物在青藏高原地下约300 km的古地壳中被发现。根椐这一矿物形成事实,推断实验室由六方相氮化硼合成立方相氮化硼需要的条件应是________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。1 mol NH4BF4 含有________mol配位键。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:P4(s)+6Cl2(g)=4PCl3(g) ΔH=akJ·mol-1
P4(s)+10Cl2(g)=4PCl5(g) ΔH= bkJ·mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为ckJ·mol-1,PCl3中P-Cl键的键能为1.2ckJ·mol-1
下列叙述正确的是( )
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)=PCl5(s)的反应热ΔH
C.Cl-Cl键的键能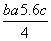 kJ·mol-1
kJ·mol-1
D.P-P键的键能为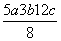 kJ·mol-1
kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)元素的第一电离能:Al________Si(填“>”或“<”)。
(2)基态Mn2+的核外电子排布式为________。
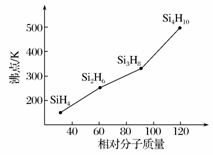
(3)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是_________________________________。
(4)硼砂是含结晶水的四硼酸钠,其阴离子Xm-(含B、O、H三种元素)的球棍模型如下图所示:
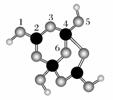
①在Xm-中,硼原子轨道的杂化类型有________;配位键存在于________原子之间(填原子的数字标号);
m=________(填数字)。
②硼砂晶体由Na+、Xm-和H2O构成,它们之间存在的作用力有________ (填序号)。
A.离子键 B.共价键 C.金属键
D.范德华力 E.氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
C.工业上常用电解法制备元素C、D、E的单质
D.化合物AE与CE古有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源: 题型:
32S与33S互为同位素,下列说法正确的是
A.32S与33S原子的最外层电子数均为2
B.32S与33S具有相同的中子数
C.32S与33S具有不同的电子数
D.32S与33S具有相同的质子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com