
【题目】下列关于化学观或化学研究方法的叙述中,错误的是 ( )
A. 在化工生产中应遵循“绿色化学”的思想
B. 在过渡元素中寻找优良的催化剂
C. 利用金属与稀盐酸反应的快慢可以判断金属的活动性
D. 根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
科目:高中化学 来源: 题型:
【题目】一位同学为探究元素周期表中元素性质的递变规律,设计了如下列实验.
(1)根据题意解答 (i)将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果:与盐酸反应最剧烈,与盐酸反应的速度最慢;与盐酸反应产生的气体最多.
(ii)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 .
(2)利用如图装置可验证同主族元素非金属性的变化规律: 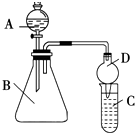
(i)仪器B的名称为 , 干燥管D的作用为 .
(ii)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液的现象,即可证明.从环境保护的观点考虑,此装置缺少尾气处理装置,可用溶液吸收尾气.
(iii)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液的现象,即可证明.但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有溶液的洗气瓶除去.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一化学反应中,其产物的总能量为80kJ,如果该反应是放热反应,那么反应物的总能量可能是( )
A.100KJ
B.60KJ
C.50KJ
D.30KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有下列键型的物质,可能为单质的是
A. 只有离子键的物质 B. 既有离子键,又有非极性键的物质
C. 既有极性键,又有离子键的物质 D. 只有非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.0mL 0.10molL﹣1的NaOH溶液中逐滴加入0.10molL﹣1的醋酸溶液,溶液pH随醋酸溶液体积的变化如图所示.下列说法正确的是( ) 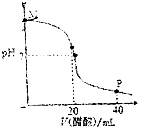
A.N点处恰好完全反应,c(CH3COO﹣)=c(CH3COOH)
B.O点处显中性,c(CH3COO﹣)=c(Na+)=c(H+)=c(OH﹣)
C.M点到O点过程中,可能出现c(CH3COO﹣)>c(Na+)
D.P点处显酸性,c(CH3COO﹣)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2、O2、N2 3种气体分别放在三个不同的密闭容器中,当它们的温度、密度完全相同时,这3种气体的压强(P)大小关系正确的是
A. P(H2)=P(O2)=P(N2) B. P(O2)> P(N2)> P(H2)
C. P(H2)> P(N2) > P(O2) D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池.若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干澡后称重,总质量为47g,试计算产生氢气的体积(标准状况) .
(2)利用下列反应:Fe+2Fe3+=3Fe2+ , 设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):负极电极反应;正极材料 , 正极电极反应 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com