
【题目】氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.已知在酸性条件下,KMnO4被还原为Mn2+。用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O,当有6mol H2SO4参加反应的过程中,有___mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的离子方程式为___。
(3)取300mL2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成KIO3,则消耗KMnO4的物质的量的是___mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___,又变为棕黄色的原因是___。
【答案】10 2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2+ +8H2O 0.72 2Fe3++SO32-+H2O=2Fe2++SO42-+2H+ H+与NO3-组成的硝酸把Fe2+氧化
【解析】
(1)在3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O中H2O2中氧元素化合价从-1价升高为0价,是还原剂,且每3molH2SO4参加反应,有5molH2O2被氧化;
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2,自身被还原生成MnSO4,同时溶液中还生成K2SO4、H2O,据此写出发生反应的离子方程式;
(3)n(KI)=0.3L×2mol/L =0.6mol,与一定量的酸性KMnO4溶液恰好反应,生成KIO3,则n(KIO3)=0.6mol,结合化合价的变化计算转移的电子的数目,可计算消耗KMnO4的物质的量;
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,铁离子和亚硫酸根离子反应生成亚铁离子导致溶液呈浅绿色;硝酸能将亚铁离子氧化生成铁离子。
(1)在3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O中H2O2中氧元素化合价从-1价升高为0价,是还原剂,且每3molH2SO4参加反应,有5molH2O2被氧化,则当有6mol H2SO4参加反应的过程中,有![]() =10mol H2O2被氧化。
=10mol H2O2被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2,自身被还原生成MnSO4,根据原子守恒知,同时溶液中还生成K2SO4、H2O,发生反应方程式为2KMnO4+5H2C2O4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O,则该反应的离子方程式为2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2+ +8H2O;
(3)n(KI)=0.3L×2mol/L =0.6mol,与一定量的酸性KMnO4溶液恰好反应,生成KIO3,则n(KIO3)=0.6mol,转移电子的物质的量为0.6mol×6=3.6mol,KMnO4的还原产物为Mn2+,则由电子守恒可知消耗KMnO4的物质的量为![]() =0.72mol;
=0.72mol;
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,铁离子和亚硫酸根离子发生氧化还原反应生成亚铁离子导致溶液呈浅绿色,离子方程式为2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;酸性条件下,硝酸根离子具有强氧化性,所以硝酸能将亚铁离子氧化生成铁离子,则溶液又变为黄色。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室制得气体中常含有杂质,影响其性质的检验。下图A为除杂装置,B为性质检验装置,完成下列表格:
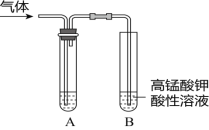
序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 无水乙醇与浓硫酸共热,反应的化学方程式是______ | ___ |
② | 乙烯 | 溴乙烷与NaOH的乙醇溶液共热,反应的化学方程式是_____ | ___ |
③ | 乙炔 | 向电石中滴加饱和食盐水,反应的化学方程式是___ | ____ |
Ⅱ.为探究乙酸乙酯的水解情况,某同学取大小相同的3支试管,分别加入以下溶液,充分振荡,放在同一水浴中加热相同时间,观察到如下现象。
试管编号 | ① | ② | ③ |
实验操作 |
|
|
|
实验现象 | 酯层变薄 | 酯层消失 | 酯层基本不变 |
(1)试管②中反应的化学方程式是__________。
(2)设计试管③实验的作用是__________。
(3)实验结论是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维纶(聚乙烯醇缩甲醛纤维)可用于生产服装、绳索等。其合成路线如下:
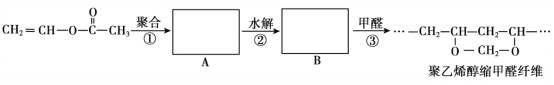
下列说法不正确的是
A.反应①是加聚反应
B.高分子A的链节中只含有一种官能团
C.通过质谱法测定高分子B的平均相对分子质量,可得其聚合度
D.反应③的化学方程式为:![]() +nHCHO→
+nHCHO→![]() +(2n-1)H2O
+(2n-1)H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察图中 A、B、C 三个装置,回答下列问题:
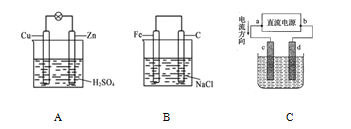
(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,可观察到锌片上有气泡,再平行插入一铜片,可观察到铜片上_________(填“有”或“没有”)气泡产生。用导线把锌片和碳棒连接起来组成一个原电池(图A),正极的反应式为_______。
(2) 如果烧杯中最初装入的是 500 mL 2 mol·L-1 硫酸溶液,构成铜锌原电池,当收集到 11.2 L(标准状况下)H2 时,溶液体积变化忽略不计,则烧杯内溶液中硫酸的物质的量的浓度为_______mol/L。
(3) 如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(图 B),放置数天后,铁片生锈。负极反应式为_______。
(4) 图 C 是电解 CuCl2 溶液的装置,其中 c、d 为石墨电极。
①正极为_______(填“a”或“b”)。
②阳极电极反应式为_______,检验该阳极产物的方法是将_______试纸靠近电极。
③电解一段时间后发现阴极增重 6.4 g,若该电解反应所需的电子全部由氢氧燃料电池提供,则至少需要消耗_______L 氢气(标准状况下)才能满足需要。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在CH3COOH分子中的所有碳原子和氧原子都在同一平面
B.在 中单体为
中单体为![]() 和NC-CHO
和NC-CHO
C.1mol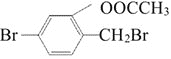 与NaOH溶液完全反应,消耗NaOH5mol
与NaOH溶液完全反应,消耗NaOH5mol
D.![]() 与Br21︰1加成可有4种加成产物
与Br21︰1加成可有4种加成产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
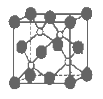
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯(C3H6)是重要的有机化工原料。下图为丙烷直接脱氢法中丙烷和丙烯的平衡体积分数与温度、压强的关系(图中的压强分别为104Pa和105 Pa)。
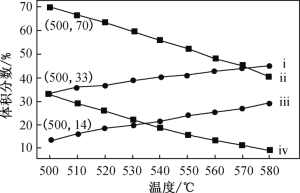
①104 Pa时,图中表示丙烯的曲线是____(填“ⅰ”、“ⅱ”、“ⅲ”或“ⅳ”)。
②104 Pa、500 ℃时,主反应用平衡分压代替平衡浓度表示的化学平衡常数Kp=_____(已知:气体分压=气体总压×体积分数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.用分液漏斗可以分离乙酸乙酯和饱和碳酸钠溶液
B.用溴水除去甲烷中的乙烯气体
C.碳酸钠是焙制糕点所用的发酵粉主要成分之一
D.蒸馏是分离液态混合物一种常用方法,广泛应用于石油工业
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰乙酸乙酯在医药上常用于合成维生素B。某化学小组在实验室中用如图装置制备乙酰乙酸乙酯。
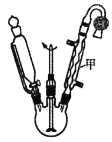
已知:ⅰ.2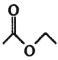
![]()
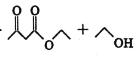
ⅱ.有关物质的性质:
沸点/℃ | 水中溶解性 | |
乙酸乙酯 | 77.2 | 难溶 |
乙酰乙酸乙酯 | 181 | 微溶 |
乙酸 | 118 | 易溶 |
实验步骤:
①向三颈烧瓶中加入9.2g无水乙酸乙酯,迅速加入0.1g切细的金属钠。水浴加热反应液,缓慢回流约2h至金属钠全部反应完。停止加热,冷却后向反应混合物中加入50%乙酸至反应液呈弱酸性。
②向反应混合物中加入等体积的饱和食盐水,分离得到有机层。
③水层用5mL无水乙酸乙酯萃取,分液。
④将①②所得有机层合并,洗涤、干燥、蒸馏得到乙酰乙酸乙酯粗产品。
⑤粗产品纯化得到乙酰乙酸乙酯4.2g。
回答下列问题:
(1)仪器甲的名称是__,水从__(填“上”或“下”)口进入。
(2)步骤②中加入饱和食盐水的作用是__。
(3)步骤④中洗涤时用饱和NaHCO3溶液,目的是__。
(4)步骤⑤中粗产品纯化的操作名称是__。
(5)本实验的产率为__%(结果保留3位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com