
【题目】磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )
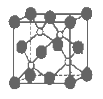
A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
科目:高中化学 来源: 题型:
【题目】回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________________________。
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子方程式:______________。
②乙同学取336mL(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为:______________。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为___________。
(3)向100mL水中投入Na和Al共16克,充分反应后剩余金属1g。计算放出H2的体积为________升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为________mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml)_________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图与表述一致的是
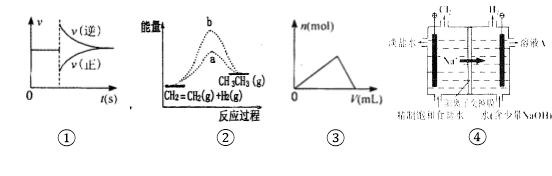
A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②b曲线表示反应CH2=CH2(g)+H2(g)→CH3-CH3(g)ΔH <0,使用催化剂时,反应过程中的能量变化
C.曲线图③可以表示向一定量的氢氧化钠溶液中滴加一定浓度氯化铝溶液时产生沉淀的物质的量变化
D.图④电解饱和食盐水的装置中阴极的电极反应式为:2H++ 2e- = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度 | 水溶性 |
A | C2H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是( )
A.分馏B.升华C.萃取D.分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.已知在酸性条件下,KMnO4被还原为Mn2+。用所学知识回答问题:
(1)3H2SO4+2KMnO4+5H2O2=K2SO4+2MnSO4+5O2↑+8H2O,当有6mol H2SO4参加反应的过程中,有___mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的离子方程式为___。
(3)取300mL2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成KIO3,则消耗KMnO4的物质的量的是___mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是___,又变为棕黄色的原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白皮杉醇具有抗炎、抗菌、抗氧化、抗白血病、提高免疫调节功能等功效,其人工合成过程涉及了如下转化:
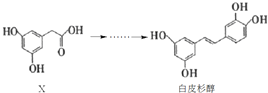
下列说法正确的是
A.X的分子式为C8H10O4
B.化合物X、白皮杉醇均可与Na2CO3溶液反应并放出气体
C.白皮杉醇与浓溴水反应时,最多可消耗6molBr2
D.在一定条件下,白皮杉醇可发生加成、取代、氧化和聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3L常温常压下的NO2依次通过盛有足量的下列物质,碳酸氢钠溶液、浓硫酸、过氧化钠固体,最后所得到的气体通入足量的水中,最后得到的气体及其体积(常温常压下)为( )
A.1L O2B.0.25L O2C.0.25L NOD.0.5L O2和1L NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24L![]() 中含有的极性键数目为0.2
中含有的极性键数目为0.2![]()
B. 13.8g![]() 和
和![]() 的混合气体与足量水反应,转移的电子数为0.2
的混合气体与足量水反应,转移的电子数为0.2![]()
C. 足量铜与含0.2mol![]() 的浓硫酸反应,生成
的浓硫酸反应,生成![]() 分子数为0.1
分子数为0.1![]()
D. 常温下,pH均为4的![]() 溶液和
溶液和![]() 溶液各1L,水电离出的
溶液各1L,水电离出的![]() 数目均为
数目均为![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A.在干冰晶体中,每一个二氧化碳分子周围有12个二氧化碳分子紧密相邻
B.金刚石网状结构中,由共价键构成的碳原子环中,最小的环上有4个碳原子
C.熔点由高到低的顺序是:金刚石>碳化硅>晶体硅
D.在12g金刚石晶体中,含共价键为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com