
将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表。则下列说法正确的是( )
|
物质 |
乙醇 |
氧气 |
水 |
二氧化碳 |
X |
|
反应前质量/g |
4.6 |
8.0 |
0 |
0 |
0 |
|
反应后质量/g |
0 |
0 |
5.4 |
4.4 |
a |
A.表中a的值为2.6 B.X一定是该反应的催化剂
C.X可能含有氢元素 D.若起始时氧气的质量是10g,则无X生成
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
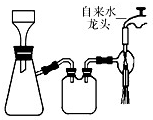 (2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:
(2013?江苏三模)三草酸合铁(Ⅲ)酸钾晶体的化学式为K3[Fe(C2O4)3]?nH2O,常作为有机反应的催化剂.实验室可用(NH4)2Fe(SO4)2?2H2O等为原料制备,实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com