
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收累积而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。已知元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体。
(1)Cr3+与Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是____
(2)利用硫酸工业废气中的SO2可以处理酸性含铬废水,用离子方程式表示反应原理:_______________
(3)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________
(4)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1 的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
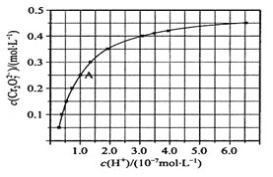
①由图可知,溶液酸性增大,CrO42的平衡转化率_________(填“增大“减小”或“不变”),
② 据A点数据,计算出该转化反应的平衡常数__________。
【答案】蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液 Cr2O72- +3SO2 +2H+ =2Cr3+ +3SO42- +H2O 2Cr3++3H2O2+10OH-=2CrO42- +8H2O 增大 1.0×1014 (mol·L1)-3
【解析】
(1)溶液Cr3+(蓝紫色)和氢氧化钠溶液反应生成Cr(OH)3为难溶于水的灰蓝色固体,和氢氧化铝性质相似为两性氢氧化物,溶于强碱;
(2)利用氧化还原反应中得失电子守恒、电荷守恒和原子守恒进行配平;
(3)利用守恒原则配平离子方程式;
(4)由图可知,溶液酸性增大,平衡2CrO42-+2H+![]() Cr2O72-+H2O正向进行,CrO42的平衡转化率增大;根据平衡常数的公式计算。
Cr2O72-+H2O正向进行,CrO42的平衡转化率增大;根据平衡常数的公式计算。
(1)Cr3+与Al3+的化学性质相似可知Cr2(SO4)3溶液中逐滴加入NaOH溶液,先生成Cr(OH)3灰蓝色沉淀,继续加入NaOH后沉淀溶解,生成绿色Cr(OH)4-;
故答案为:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液。
(2)利用SO2的还原性将废液中的Cr2O72-还原成Cr3+,则Cr2O72-将SO2氧化为SO42-,根据得失电子守恒、电荷守恒和原子守恒,配平离子方程式为:Cr2O72- +3SO2+2H+=2Cr3+ +3SO42-+H2O,故答案为:Cr2O72- +3SO2+2H+=2Cr3+ +3SO42-+H2O。
(3)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为2Cr3++3H2O2+10OH-=2CrO42- +8H2O,故答案为:2Cr3++3H2O2+10OH-=2CrO42- +8H2O。
(4)①由图可知,溶液酸性增大,平衡2CrO42-+2H+![]() Cr2O72-+H2O正向进行,CrO42的平衡转化率增大,故答案为:增大。
Cr2O72-+H2O正向进行,CrO42的平衡转化率增大,故答案为:增大。
②A点Cr2O72-的浓度为0.25mol/L,根据Cr元素守恒可知CrO42-的浓度为0.5mol/L;H+浓度为1×10-7mol/L;此时该转化反应的平衡常数为c(Cr2O72-)/c2(CrO42-)c2(H+)=0.25/0.52×(1×10-7)2=1.0×1014(mol·L1)-3,
故答案为:1.0×1014(mol·L1)-3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1mol·L-1KOH溶液中滴加0.1 mol·L -1HA(弱酸)溶液,混合溶液中水电离出的c(OH-)与HA溶液体积之间的关系如图I所示:向20.00mL0.1 mol ·L-1 HA溶液中滴加0. 1mol ·L-1 KOH溶液,混合溶液中水电离出的c(OH-)与KOH溶液体积之间的关系如图II所示。

下列有关说法正确的是
A. A点、X点对应溶液中水的电离程度相同
B. B点、Y点对应溶液的pH相等
C. C点、Z点对应溶液中都存在:c(OH-)=c(H+)+c(HA)
D. D点、W点对应溶液中分别都存在:c(K+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是
A. 用N2表示的反应速率为0.15mol·L-1·s-1 B. 2s时H2的转化率为40%
C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.pH=7的溶液一定是中性溶液
B.酸雨就是指呈酸性的雨水
C.医学上可用液氮保存待移植的活性器官
D.浓H2SO4 沾到皮肤上,应先用水冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+![]() O2(g)===
O2(g)===![]() P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为 。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为 ,反应过程中放出的热量为 。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。

则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
CH3CH2OH(g)+3H2O(g) 下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 反应需在300℃进行可推测该反应是吸热反应
C. 充入大量CO2气体可提高H2的转化率
D. 从平衡混合气体中分离出CH3CH2OH和H2O可提高CO2和H2的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲苯( )与氯气在光照条件下反应主要生成2,4-二氯甲苯(
)与氯气在光照条件下反应主要生成2,4-二氯甲苯( )
)
B. 溴水可以用来区分直馏汽油和裂化汽油
C. 向淀粉水解后的溶液中依次加入过量氢氣化钠溶液、几滴碘液,溶液不变蓝则证明淀粉己完全水解
D. 按系统命名法,化合物 的名称是:2,3,4-三甲基-2-乙基戊烷
的名称是:2,3,4-三甲基-2-乙基戊烷
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com