
【题目】KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐(主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
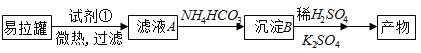
(1)为尽量少引入杂质,试剂①应选用__________(填序号)
A.NaOH溶液 B.H2SO4溶液 C.氨水 D.HCl溶液
(2)易拉罐溶解过程中主要反应的化学方程式为______________;
(3)由滤液A生成沉淀B反应的离子方程式为:_________________;
(4)明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,离子方程式为______________。
【答案】(1)a;
(2)2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(4)Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-。
【解析】
试题分析:(1)根据铝能溶解在强酸和强碱性溶液,而铁和镁只能溶解在强酸性溶液中的性质差异,可选择NaOH溶液溶解易拉罐,可除去含有的铁、镁等杂质,故答案为:a;
(2)铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑;故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)滤液中通入二氧化碳后,与AlO2-反应生成氢氧化铝沉淀,反应式为CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-,故答案为:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(4)假设Ba(OH)2的物质的量为1mol,水溶液中Ba2+恰好沉淀时,需硫酸根离子1mol,所以明矾与Ba(OH)2的物质的量之比为1:2,反应的离子反应为:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O,故答案为:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
电离能(KJ/mol) | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15399 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区。
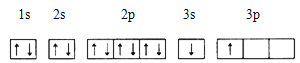
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与CN-互为等电子体的单质的电子式 。
③六氰合亚铁离子[Fe(CN)6]4-中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如右图所示。请据此回答下列问题:
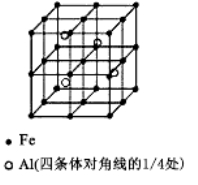
①确定该合金的化学式 。
②若晶体的密度=ρg/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元求X、Y、W在元素周期表中的相对位置如下图所示,其中Z为地壳中含量最高的金属元素。下列说法正确的是
X | ||||||
Y | Z | W |
A.工业上电解YW饱和溶液冶炼金属Y
B.气态氢化物的稳定性:W>X
C.简单离子半径的大小顺序:r(Y+)>r(X-)
D.Y、W的最高价氧化物的水化物均能溶解金厲Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Favorskii反应是化工生产中的重要反应,它是利用炔烃与羰基化合物在强碱性下发生反应,得到炔醇,反应原理为:
以下合成路线是某化工厂生产流程的一部分:

已知:
请回答下列问题:
(1)写出F中官能团的名称 。
(2)写出D的名称(系统命名) 。
(3)④的反应类型是 ;B的结构简式是 。
(4)写出反应⑥的化学方程式为 。
(5)已知H与D互为同分异构体, H属于炔烃,其核磁共振氢谱有3种吸收峰,则H的结构简式为: (任写一种)。
(6)有关C的说法正确的是
a.能使溴的四氯化碳溶液褪色 b.能和氢氧化钠溶液反应
c.能使酸性高锰酸钾褪色 d.能与乙酸发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有H2SO4、MgCl2、Al2(SO4)3、NH4Cl、NaCl中的几种物质,往该溶液中逐渐加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:
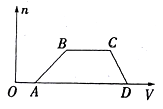
(1)溶液中一定含有的溶质是__________(填化学式)。
(2)溶液中一定不含有的溶质是__________(填化学式)。
(3)溶液中可能含有的溶质是__________(填化学式),用焰色反应可以判断是否含有该物质,现象是_________________。
(4)分别写出AB段、CD段发生的离子方程式:① AB段为_________________;②CD段为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为:2Ag+Cl2===2AgCl。下列说法正确的是( )
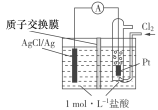
A.正极反应为AgCl+e-===Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸反应,用下图装置进行有关实验。请回答下列问题:
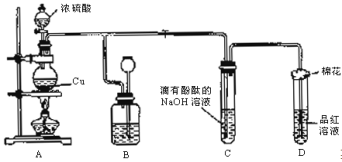
(1)装置A中发生的化学反应的化学方程式为 ;
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是 (填序号);
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2 ,而D中则是由于SO2具有 ;
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是 ;
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色,为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是 (填序号);
①观察稀H2SO4溶液呈无色
②观察CuSO4粉末呈白色
③稀释CuSO4溶液,溶液蓝色变浅
④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色
⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色
(6)若实验中用7.2g铜片和12.5mL18.0ml·L-1的浓硫酸在加热条件充分反应,最终铜片仍有剩余。根据所学的知识,某同学认为溶液中一定还有硫酸剩余,其理由是 。
假定反应前后溶液的体积不变,设剩余硫酸的浓度为amol/L,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾 mol(用含a的代数式表示,要化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)
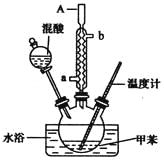
实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:
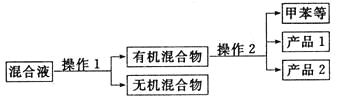
操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com