
【题目】垃圾分类回收,有利于节约资源、保护环境。下列可回收垃圾中其材质为金属的是
A.废报刊B.碎玻璃C.易拉罐D.塑料瓶
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为石墨电极,d为铁电极,通电进行电解。假设在电解过程中产生的气体全部逸出,下列说法正确的是( )

A.乙烧杯中的d电极反应式为Fe-2e-=Fe2+
B.电解一段时间后,将甲、乙两溶液混合,一定会产生沉淀
C.当b极增重5.4g时,d极产生的气体为2.24L(标况)
D.甲烧杯中溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁橄榄石是天然的铁矿石,由实验测得铁橄榄石的摩尔质量为204 g·mol-1,其中铁元素的质量分数为54.9%,可以通过如下反应和相应的数据推知它的化学式。其中A ~ J是中学化学中的常见物质,G是一种红褐色固体,D是一种难溶于水的含氧酸,J是一种主要的温室气体,A为强碱,其焰色反应呈黄色,E和B分别与酸化的硝酸银溶液反应时的实验现象相同,均有白色沉淀产生,流程中的部分生成物已略去。

回答下列问题:
(1)A的电子式:__________________。
(2)铁橄榄石的化学式:__________________。
(3)写出H → G的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关细胞分子组成的叙述,正确的是( )
A. 豌豆细胞中遗传信息的携带者的基本单位是氨基酸
B. 生物体内的糖绝大多数以单糖的形式存在
C. 一个蛋白质分子只有一个氨基和一个羧基
D. 磷脂是细胞膜和细胞器膜的重要组成成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用软锰矿(主要成分是MnO2,含少量Al2O3和SiO2)和闪锌矿(主要成分是ZnS,含少量FeS、CuS等杂质)为原料制备MnO2和Zn(干电池原料),其简化流程如下:
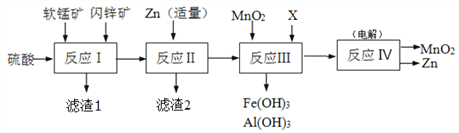
已知:反应Ⅰ中所有金属元素均以离子形式存在。
回答下列问题:
(1)滤渣1中除了SiO2以外,还有一种淡黄色物质,该物质是由MnO2、CuS与硫酸共热时产生的,请写出该反应的离子方程式________________________________。
(2)反应Ⅱ中加入适量金属锌的目的是为了回收某种金属,滤渣2的主要成分是______(填名称)。
(3)反应Ⅲ中MnO2的作用是______,另外一种物质X可以是______。(填字母代号)
a.MgO b.Zn(OH)2 c.Cu2(OH)2CO3 d.MnCO3
(4)反应Ⅳ中电极均是惰性电极,写出阳极电极反应式_______________。本工艺可以循环利用的物质有MnO2、Zn和_____。
(5)已知:H2S的电离常数K1=1.0×107,K2=7.0×1015。0.1 mol/L NaHS的pH___7(填“>”“=”或“<”),理由是________________________________________。
(6)在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L1 Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS浓度为1.0×104 mol·L1时,Mn2+开始沉淀,则a=________。[已知:Ksp(MnS)=1.4×1015]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式_________________。


(2)砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
②0~10 min内,I的反应速率v(I)=_______。
③在该条件下,上述反应的平衡常数K=______。
④升高温度,溶液中AsO43-的平衡转化率减小,则该反应的 ΔH______0(填“大于”“小于”或“等于”)。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样0.2000 g溶于NaOH溶液,得到含AsO33-和AsO43-的混合溶液。
②上述混合液用0.02500 molL-1的I2溶液滴定,用____ 做指示剂进行滴定。重复滴定2次,平均消耗I2溶液40.00 mL。则试样中As2O5的质量分数是______。
(4)雄黄(As4S4)在空气中加热至300℃时会生成两种氧化物,其中一种氧化物为剧毒的砒霜(As2O3),另一种氧化物为______(填化学式),可用双氧水将As2O3氧化为H3AsO4而除去,写出该反应的化学方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)能源危机是当前全球问题,开源节流是应对能源危机的重要举措。下列做法有助于能源“开源节流”的是________(填序号)。
a.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
b.大力开采煤、石油和天然气以满足人们日益增长的能源需求
c.开发太阳能、水能、风能、地热能等新能源、减少使用煤、石油等化石燃料
d.减少资源消耗,增加资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们燃烧氧气不足时生成一氧化碳,充分燃烧生成二氧化碳,反应中放出的热量如下图所示。

①在通常状况下,金刚石和石墨中_______更稳定,石墨的燃烧热为__________。
②12 g石墨在一定量空气中燃烧,生成气体36 g,该过程放出的热量为_______。
(3)由石墨转变成金刚石的反应的ΔS=+1.6J·mol-1·K-1,则为了保持此反应自发进行,温度应______(填“低于”或“高于”)______K。
(4)已知熔融碳酸盐燃料电池的工作原理如下图所示:

①放电过程中K+和Na+向电极_______(填“A”或“B”)移动。
②该电池的负极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组分类正确的是
选项 | 强电解质 | 弱电解质 | 非电解质 |
A | NaCl | HClO | CH3CH2OH |
B | NaOH | CaCO3 | SO3 |
C | HF | CuSO4 | NH3 |
D | H2SO4 | H2O | Cu |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com