
下表中对离子方程式的评价不合理的是

科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1mol甲醇中含有C—H键的数目为4NA
B.常温下,2.24LCl2完全与NaOH溶液反应,转移的电子数目一定为0.1 NA
C.7.8g由Na2S和Na2O2组成的混合物中含有阴离子的数目为 0.1NA
D.80℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2 NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省荆州市部分县市高三上学期期末统考理综化学试卷(解析版) 题型:填空题
(14分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)工业废水中含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的危害,必须进行处理。常用的处理方法是电解法,该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解的进行,阴极附近溶 液pH升高,产生Cr(OH)3沉淀。
(1)用Fe作电极的目的是 。
(2)阴极附近溶液pH升高的原因是 (用电极反应式解释)溶液中同时生成的沉淀还有 。
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:

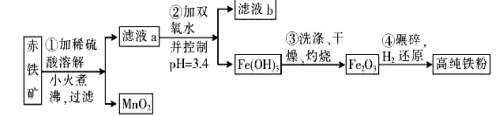
已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(3)步骤②中加双氧水的目的是 ,pH控制在3. 4的作用是 。已知25°C时,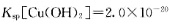 ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(4)如何判断步骤③中沉淀是否洗涤干净?
(5)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省南阳市高三上学期期末理综化学试卷(解析版) 题型:选择题
分子式为C10H12O2的有机物,满足以下两个条件:①苯环上有两个取代基,②能与NaHCO3反应生成气体。则满足条件的该有机物的同分异构体有
A.9 B.10 C.12 D.15
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省唐山市高三上学期期末理综化学试卷(解析版) 题型:填空题
(14分)节能减排是当下环境保护的重点。
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g),△H<0
CO2(g)+H2(g),△H<0
800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=1.0。

①从起始经过5 min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)= ;平衡时,容器中CO的转化率为 。
②下图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况。则t2时刻发生改变的条件可能是 。(写出一条)

(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:
CO(g)+l/2O2(g) CO2(g)降低其浓度。
CO2(g)降低其浓度。
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示。请在表中的空格处填写“>"“<”或“="。

②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L。若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为 mol/L(请保留两位有效数字)。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9。现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为 mol/L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:简答题
(11分)根据物质相似性、特殊性来学习元素性质是常见的学习方法。
(1)铍(Be)与铝元素相似,其氧化物及氢氧化物具有两性,请写出BeO与盐酸反应的离子方程式_____,Be(OH)2溶于NaOH溶液的化学方程式为:Be(OH)2+2NaOH=Na2 BeO2+2H2 O,往10.0mL1.00mol·L-1的Be(NO3)2溶液中逐滴加入等浓度的NaOH溶液,请在以下坐标图中画出沉淀量随NaOH溶液加人量的变化图:

(2)锗与硅元素相似,锗也是良好的半导体,以下是工业冶炼锗的简单流程图:

①GeCl4的晶体类型为__________。
②写出过程III发生反应的化学方程式__________。
③以下有关工业冶炼锗的说法正确的是__________。
A.GeO2与SiO2性质相似,均易与盐酸反应
B.过程II的蒸馏是利用GeCl4难溶于水的性质实现的
C.过程IV发生的反应中,GeO2作氧化剂
D.上述过程涉及的基本反应类型有复分解反应、置换反应
(3)某同学为了探究硫与浓硝酸的反应产物,将硫与浓硝酸混合,结果生成一种纯净无色气体A,A遇空气变红棕色,据此写出硫与浓硝酸反应的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省泉州市高三上学期期末化学试卷(解析版) 题型:选择题
下列物质性质与应用及其对应关系均正确的是
选项 | 性质 | 应用 |
A | 碳酸氢钠可与烧碱反应 | 可用碳酸氢钠作糕点膨松剂 |
B | AgCl难溶于稀硝酸 | 可用稀硝酸和AgNO3溶液检测Cl一 |
C | 浓硫酸具有强氧化性,而稀硫酸的氧化性较弱 | 可用浓硫酸替代稀硫酸与锌反应快速制氢气 |
D | 碳单质性质稳定 | 可在纯铁中加入少量炭增强抗腐蚀性 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省等三校高三上学期联考化学试卷(解析版) 题型:实验题
(16分)某校化学研究性学习小组查阅资料了解到以下内容:
乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,草酸在常温下呈无色晶体状,其晶体的熔化温度低于草酸的分解温度,且易升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________________。
(2)取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)
①该实验说明草酸具有________(填“氧化”或“还原”)性,该反应的反应速率先慢后快的主要原因可能是_______ _ ______。
②请配平该反应的离子方程式:______MnO4-+____H2C2O4+____ ===____Mn2++____CO2↑+____。
(3)为了探究草酸的不稳定性,某同学设计了如下实验装置:

①C、H装置均变浑浊,E处无现象,G玻璃管里黑色变红色,写出A中反应的化学方程式: 。
②上述装置中,B装置的作用是 。 D的作用是 。从环境保护角度来看,该方案的不足之处是 。
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol·L-1的NaOH溶液中充分反应,测得反应后溶液呈酸性,形成的溶液中各离子的浓度由大到小的顺序为_______________(用离子符号表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省宁德市高三上学期期末化学试卷(解析版) 题型:选择题
下列说法正确的是
A.离子化合物中可能含有共价键
B.非金属元素只能形成共价化合物
C.阳离子只能被还原
D.阴离子中不含金属元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com