
| A. | Al是地壳中含量最多的元素 | |
| B. | Al2O3的熔点很高,是一种较好的耐火材料 | |
| C. | 向Al2(SO4)3溶液中滴加过量NaOH溶液制备Al(OH3) | |
| D. | 铝制品在生活中被广泛使用,说明铝是一种不活泼的金属 |
分析 铝为活泼金属,在地壳中含量丰富,对应的化合物中,氧化铝熔点高,常用于难高温材料,氢氧化铝为两性氢氧化物,易与强碱反应,制备氢氧化铝,应用铝盐和弱碱反应,以此解答该题.
解答 解:A.地壳中含量最多的元素为O元素,铝为含量最多的金属元素,故A错误;
B.氧化铝熔点高,常用于难高温材料,故B正确;
C.氢氧化铝为两性氢氧化物,易与强碱反应,制备氢氧化铝,应用铝盐和弱碱反应,故C错误;
D.铝易被氧化生成氧化铝,在铝表面形成一层致密的氧化铝膜,可保护铝进一步被腐蚀,故D错误.
故选B.
点评 本题考查Al及其化合物的性质,为高频考点,把握性质、现象及反应原理为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若C(s)+O2(g)=CO2(g)△H1,CO2(g)+C(s)=2CO(g)△H2,2CO(g)+O2(g)=2CO2(g)△H3,则反应热的关系:△H1=△H2+△H3 | |
| B. | 若2H2(g)+O2(g)=2H2O(1)△H4,H2(g)+$\frac{1}{2}$O2(g)=H2O(1)△H5,则反应热的关系:△H4=△H5 | |
| C. | 若2SO2(g)+O2(g)=2SO3(g)△H<O,则物质的稳定性:SO2>SO3 | |
| D. | 若断裂1molH2(g)中的H-H键、断裂1 molO2(g)中的共价键分别需要吸收436 kJ、498 kJ的能量,生成H2O(g)中的1 mol H-O键能放出463kJ的能量,则2H2(g)+O2(g)=2H2O(g)△H=-482kJ.mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | NO发生还原反应 | ||
| C. | CO是氧化剂 | D. | 反应物中O得电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇与金属钠反应 | B. | 苯和液溴反应生成溴苯 | ||
| C. | 乙烯和溴的四氯化碳溶液反应 | D. | 乙酸和乙醇反应生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
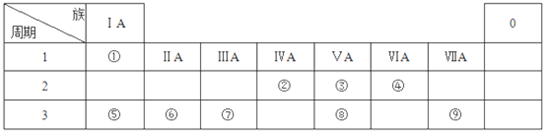
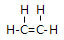 ;由④和⑥两种元素组成的化合物的电子式为
;由④和⑥两种元素组成的化合物的电子式为 ;元素⑨的原子结构示意图为
;元素⑨的原子结构示意图为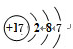 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.
已知:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com