
| A、0.9mol?L-1 |
| B、2.25mol?L-1 |
| C、1.50mol?L-1 |
| m |
| M |
| n |
| V |
| 0.045mol |
| 0.02L |


科目:高中化学 来源: 题型:
| A、原子数 | B、密度 |
| C、质量 | D、电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a为正极,b为负极;NaClO和NaCl |
| B、a为负极,b为正极;NaClO和NaCl |
| C、a为阳极,b为阴极;HClO和NaCl |
| D、a为阴极,b为阳极;HClO和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| A、该反应的正反应为吸热反应,即a<0 |
| B、当v正(H2)=v正(H2O)时该反应达到化学平衡状态 |
| C、当其他条件不变时,若缩小容器的体积,则有利于该反应平衡正向移动 |
| D、当平衡浓度符合 c(CO2)?c(H2)=c(CO)?c(H2O)时的温度为830℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、67% | B、50% |
| C、25% | D、5% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化合物 | 甲 | 乙 | 丙 | 丁 | 戊 | 己 |
| 化学式 | A2C | A2C2 | A2B2 | D2C2 | A2E | DF |
查看答案和解析>>
科目:高中化学 来源: 题型:
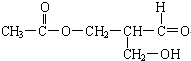 在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?
在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子,以*C表示.而且,该有机化合物具有光学活性.下列有机物是否具有光学活性?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com