
 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、该溶液中由水电离出的c(H+)=1×10-3 mol?L-1 |
| B、由pH=3的HA与pH=11的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| D、0.1 mol?L-1HA溶液与0.05 mol?L-1NaOH溶液等体积混合后所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示:
将NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水.产生1.16g白色沉淀,再向所得溶液中逐渐加入1.00mol/L的盐酸,加入盐酸的体积和生成沉淀的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
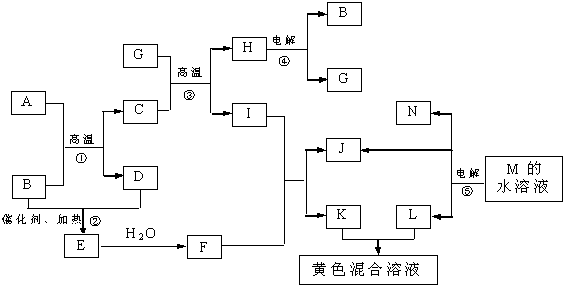
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O | ||
B、nCH3-CH=CH2
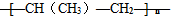 | ||
| C、CH3COO-+HCl→Cl-+CH3COOH | ||
| D、CO32-+CH3COOH→CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.9mol?L-1 |
| B、2.25mol?L-1 |
| C、1.50mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn和Al |
| B、Zn和Al |
| C、Zn和Mg |
| D、Zn和Na |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com