


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源:不详 题型:单选题
| A.常温下,甲能从水中置换出氢,而乙不能 |
| B.最高价氧化物对应的水化物碱性比较,甲比乙的强 |
| C.甲与非金属反应时失电子比乙少 |
| D.甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeCl3
FeCl3 FeI3
FeI3 FeSO4+Cu
FeSO4+Cu CuCl2+FeCl2
CuCl2+FeCl2 FeCl2+Br2
FeCl2+Br2 FeBr3+I2
FeBr3+I2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向溶液X中滴加NaOH稀溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 溶液X中无NH |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液 | 上层溶液不变红, 下层溶液紫红色 | 氧化性:Br2>Fe3+>I2 |
| C | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| D | 向漂白粉上加入较浓的盐酸,将湿润淀粉碘化钾试纸置于试管口 | 产生气泡,试纸未变蓝 | 漂白粉已经失效 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应的氧化剂是ClO- |
| B.消耗l mol还原剂,转移电子3 mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
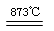 Cl2+2KIO3,下列说法正确的是
Cl2+2KIO3,下列说法正确的是| A.向KClO3溶液中滴加AgNO3溶液得到白色AgCl沉淀 |
| B.反应过程中I2置换出Cl2,由此可推断非金属性I>CI |
| C.KClO3和KIO3均属于离子化合物,都只含有离子键 |
| D.制备KIO3的反应中氯元素被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ag | B.Cu | C.Fe | D.Zn |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl2 | B.KMnO4 | C.浓盐酸 | D.FeCl3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化性:Ag+>Tl3+>Cu2+>Fe2+ | B.还原性: Fe>Cu>Ag>Tl |
| C.氧化性:Tl 3+>Ag+>Cu 2+>Fe 2+ | D.还原性: Tl +>Ag>Cu>Fe |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com