
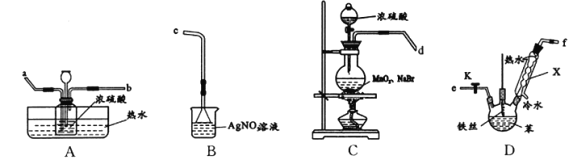
【题目】某化学小组欲通过实验探究:I.苯与液溴发生取代反应;Ⅱ.苯与液溴在催化剂作用下的反应机理。所用装罝如图所示。
已知:MnO2+2NaBr+2H2SO4![]() Br2↑+MnSO4+Na2SO4+2H2O
Br2↑+MnSO4+Na2SO4+2H2O
(1)实验室制备溴苯的化学方程式为___________________;仪器X的名称为___________。
(2)制取溴苯的实验操作步骤如下:
①连接装罝,其接口顺序为(填字母):d接____, _____接_____, ______接c;
②检査装置气密性;
③C中加入固体药品,_______,再打开D处开关K,点燃C处酒精灯;插入铁丝于混合液中,一段时间后,D中液体沸腾,原因是_________ ;
④关闭C中活塞。
(3)A中对广口瓶进行热水浴的目的是 _______________。
(4)若B中有淡黄色沉淀生成,能否确定苯与液溴发生了取代反应?_____(答“能”或“否”)。
(5)査阅文献:苯与液溴在FeBr3催化下的反应机理共分三步:
I Br2+FeBr3![]() Br++FeBr4-
Br++FeBr4-
Ⅱ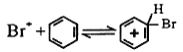
①请完成第三步反应:Ⅲ__________________________;
②该小组将A装置中浓硫酸替换成稀硫酸时实验失败,试从反应机理推测可能原因是__________。
【答案】 ![]() 球形冷凝管 a、b、c、f C处滴加浓硫酸 该反应是放热反应 防止Br2蒸气冷凝 否
球形冷凝管 a、b、c、f C处滴加浓硫酸 该反应是放热反应 防止Br2蒸气冷凝 否 ![]() 有水情况下,无法生成Br+
有水情况下,无法生成Br+
【解析】本题考查实验方案设计的评价和实验基本操作,(1)苯和液溴在铁或溴化铁作催化剂下发生取代反应,即反应方程式为:![]() ;仪器X为球形冷凝管;(2)①首先制备Br2,Br2 蒸气中混有水蒸气,需要除去,因此通过浓硫酸吸水,即d接a,然后把纯净的溴蒸气通入到装置D中参加反应,即b接e,检验溴化氢,即f接c,顺序是d→a→b→e→f→c;③装置C中固体药品,然后通过分液漏斗滴加浓硫酸,再打开装置D处开关K,,此点燃酒精灯;插入铁丝后,D中溶液沸腾,因为苯和液溴反应属于放热反应;(3)常温下溴单质呈液态,因此热水浴的目的是防止Br2蒸气冷凝;(4)从装置D中挥发出来的HBr中混有Br2蒸气,Br2蒸气也能与硝酸银反应产生淡黄色沉淀;(5)①FeBr3作催化剂,反应后还要生成FeBr3,因此反应方程式为:
;仪器X为球形冷凝管;(2)①首先制备Br2,Br2 蒸气中混有水蒸气,需要除去,因此通过浓硫酸吸水,即d接a,然后把纯净的溴蒸气通入到装置D中参加反应,即b接e,检验溴化氢,即f接c,顺序是d→a→b→e→f→c;③装置C中固体药品,然后通过分液漏斗滴加浓硫酸,再打开装置D处开关K,,此点燃酒精灯;插入铁丝后,D中溶液沸腾,因为苯和液溴反应属于放热反应;(3)常温下溴单质呈液态,因此热水浴的目的是防止Br2蒸气冷凝;(4)从装置D中挥发出来的HBr中混有Br2蒸气,Br2蒸气也能与硝酸银反应产生淡黄色沉淀;(5)①FeBr3作催化剂,反应后还要生成FeBr3,因此反应方程式为:![]() ;②有水情况下,无法生成Br+。
;②有水情况下,无法生成Br+。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A.丁达尔效应可用于鉴别胶体和溶液
B.胶体粒子的直径在1~100 nm之间
C.胶体一定是混合物
D.将FeCl3稀溶液溶于冷水即可制得Fe(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中能大量共存的一组离子是
A. Na+、Cl-、ClO-、I- B. Fe3+、Mg2+、Cl-、NO3-
C. NH4+、H+、S2-、NO3- D. H+ 、Ba2+、F-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧无汞碱性锌锰电池可用于制造隐形战机的机身涂料MnxZn(1-x)Fe2O4,该电池工作反应原理为Zn+2MnO2+2H2O![]() 2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
2MnO(OH)+Zn(OH)2。某化学小组利用废电池制涂料的工艺如下:
A.浸取:将去除表面塑料的旧电池加入水中浸取并过滤,滤液经操作a得KOH固体;
B.溶液:滤渣中加入过量稀硫酸和足量双氧水,至不再出现气泡时,过滤;
C.测成分:测步骤B中滤液成分,然后加入铁粉;
D.氧化:加入双氧水氧化;
E.调pH:滴加氨水调pH,经结晶处理得MnxZn(1-x)Fe2O4。
(1)浸取时的操作有 ______。
A.拆解、粉碎旧电池 B.降低温度 C.搅拌 D.加压
(2)操作a为________。
(3)溶渣时生成Mn2+的主要离子方程式为______________________________。
(4)若步骤C测得滤液中金属离子组成为:c(Mn2+) +c(Zn2+) =0.8mol/L, c(Fe2+ ) = 0. 1 mol/L。若滤液体积为lm3,要合成MnxZn(1-x)Fe2O4,需加入Fe粉质量为___________kg(忽略体积变化)。
(5)氧化时,因为分解所需双氧水的量比理论值大得多。其原因可能是①温度过高;②______。
(6)最后一步结晶时,处理不当易生成MnFe2O4和ZnFe2O4。要制得MnxZn(1-x)Fe2O4,最后一步结晶时需注意______________________。
(7)某小组构想用ZnSO4、MnSO4溶液为原料,以Fe作电极用电解法经过一系列步骤制得MnxZn(1-x)Fe2O4,则开始电解时阳极反应式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将pH=10的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述中不正确的是( )
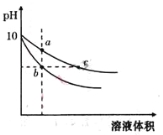
A.a、b两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中c(H+)+c(CH3COOH)=c(OH-)
D.若向上述两种溶液中分别加入相同浓度的盐酸至pH=7,则消耗盐酸体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数,若已知下列反应可以发生:
①NaCN+HNO2![]() HCN+NaNO2
HCN+NaNO2
②NaCN+HF![]() HCN+NaF
HCN+NaF
③NaNO2+HF![]() HNO2+NaF
HNO2+NaF
由此可判断下列叙述不正确的是 ( )
A.K(HCN)=7.2×10-4
B.K(HCN)<K(HF)<K(HNO2)
C.同浓度的三种盐溶液,pH(NaNO2)<pH(NaF)<pH(NaCN)
D.若已知酸性:CH3COOH<HNO2,则可以发生反应HF+CH3COONa![]() NaF+CH3COOH
NaF+CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com