
分析 (1)根据n=$\frac{N}{{N}_{A}}$分析解答;1molOH-含有电子的物质的量为10mol;
(2)根据钠离子物质的量计算3.9g的Na2X的物质的量,根据M=$\frac{m}{M}$计算Na2X的摩尔质量,进而计算X的相对原子质量;
(3)计算cg氧气含有分子数目,再根据n=$\frac{N}{{N}_{A}}$计算氧气物质的量,根据V=nVm计算氧气体积;
(4)用Na2CO3固体配制1mol/L的Na2CO3溶液250mL,则需要固体碳酸钠的物质的量n=1mol/L×0.25L=0.25mol;若用含结晶水的碳酸钠晶体(Na2CO3•10H2O)配制,则需要碳酸钠晶体质量m′=286g/mol×0.25mol/L=71.5g;
(5)由题意可知完全沉淀,则Cl-+Ag+═AgCl↓,当生成的AgCl沉淀的质量之比为3:2:1,氯离子的物质的量之比为3:2:1;
(6)根据n=$\frac{V}{{V}_{m}}$计算混合气体总物质的量,再根据总质量、总物质的量列方程计算各自物质的量,由此分析解答.
解答 解:(1)n=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{22}}{6.02×1{0}^{23}}$=0.05mol,所以质量为:0.05×17=0.85g,1molOH-含有电子的物质的量为10mol,所以0.05mol含有电子的物质的量为0.5mol,故答案为:0.85g;0.5mol;
(2)3.9g的Na2X的物质的量为$\frac{0.1mol}{2}$=0.05mol,故Na2X的摩尔质量为$\frac{3.9g}{0.05mol}$=78g/mol,则X的相对原子质量为78-23×2=32,
故答案为:78g/mol;32;
(3)cg氧气含有分子数目为b×$\frac{c}{a}$,氧气物质的量为$\frac{\frac{bc}{a}}{{N}_{A}mo{l}^{-1}}$=$\frac{bc}{a{N}_{A}}$mol,故标况下氧气体积为$\frac{bc}{a{N}_{A}}$mol×22.4L/mol=$\frac{22.4bc}{a•NA}$L,
故答案为:$\frac{22.4bc}{a•NA}$L;
(4)用Na2CO3固体配制1mol/L的Na2CO3溶液250mL,则需要固体碳酸钠的物质的量n=1mol/L×0.25L=0.25mol;若用含结晶水的碳酸钠晶体(Na2CO3•10H2O)配制,则需要碳酸钠晶体质量m′=286g/mol×0.25mol/L=71.5g,故答案为:71.5;
(5)设AgNO3溶液的浓度都是c,设体积分别为x、y、z,由题意可知完全沉淀,则Cl-+Ag+═AgCl↓,当生成的AgCl沉淀的质量之比为3:2:1,氯离子的物质的量之比为3:2:1,则cx:2cy:3cz=3:2:1,
解得x:y:z=9:3:1,
故答案为:9:3:1;
(6)混合气体总物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,
设H2和CO的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.3}\\{2x+28y=4.8g}\end{array}\right.$
解得x=0.2,y=0.1,则H2的质量为0.4g,CO2在标准状况下的体积为 2.24L,故答案为:0.4;2.24.
点评 本题考查有关物质的量的计算,明确质量、摩尔质量、物质的量的关系及摩尔质量与相对分子质量的关系即可解答.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯气和二氧化硫都有漂白性,等体积的二者混合会提高漂白效率 | |
| B. | 氢氧化铁胶体在电场的作用下向阳极移动 | |
| C. | 普通玻璃中含有石英、石灰石和纯碱 | |
| D. | 铝制餐具不宜用来长时间存放酸性、碱性或咸的食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2(g)+NO2(g)?SO3(g)+NO(g)△H<0 | B. | 4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H<0 | ||
| C. | C(s)+CO2(g)?2CO(g)△H>0 | D. | H2S(g)?H2(g)+S(s)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
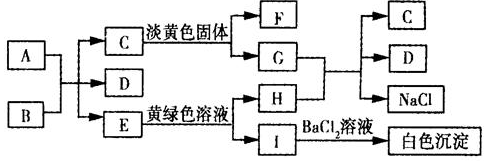
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)═2CO(g)+O2(g)的反应热△H=+2×283.0kJ/mol | |
| C. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝、小苏打、纯碱均可用作胃酸中和剂 | |
| B. | 古代的陶瓷、水泥、石英玻璃等,都是硅酸盐产品 | |
| C. | 将草木灰(含K2CO3)与NH4Cl混合使用会降低肥效 | |
| D. | 石油的分馏、煤的干馏等物理变化在生产中有着重要的地位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、101kPa时,2H2(g)+O2(g)═2H2O(g)△H=-Q kJ•mol-1,则H2的燃烧热为$\frac{1}{2}$Q kJ•mol-1 | |
| B. | B、同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H相同 | |
| C. | C、500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热3kJ,其热化学方程式为N2(g)+3H2(g) $?_{催化剂}^{500℃,30MPa}$2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com