
【题目】下列叙述中正确的是( )
A. 纯碱从物质的分类看不属于碱 B. 由一种元素组成的物质一定是单质
C. 单质只能用置换反应制取 D. 含氧元素的化合物称为氧化物
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重114 g,则某气体的相对分子质量为( )
A. 32 B. 60 C. 28 D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中能证明碳的非金属性比硅强的是( )
①往Na2SiO3溶液中通入CO2产生白色沉淀
②石墨是导体,晶体硅是半导体
③制玻璃过程中发生反应Na2CO3+SiO2 ![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
④CH4比SiH4稳定.
A.①④
B.②③
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以锂辉石为原料生产碳酸锂的部分工业流程如下:
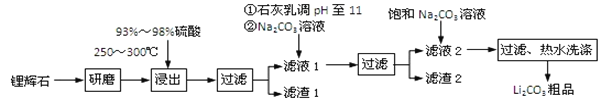
已知:
①锂辉石的主要成分为Li2O·Al2O3·4SiO2,其中含少量Ca、Mg元素。
②Li2O·Al2O3·4SiO2 + H2SO4(浓) ![]() Li2SO4 + Al2O3·4SiO2·H2O
Li2SO4 + Al2O3·4SiO2·H2O
③某些物质的溶解度(s)如下表所示。
T/℃ | 20 | 40 | 60 | 80 |
s(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
s(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
(1)从滤渣Ⅰ中分离出Al2O3的流程如下图所示。请写出生成沉淀的离子方程式______。
![]()
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)________________________________________________。
(3)最后一个步骤中,用“热水洗涤”的原因是______________________________。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液做阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入少量NH4HCO3溶液并共热,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是_________________________
②电解后,LiOH溶液浓度增大的原因_________________,b中生成Li2CO3反应的化学方程式是___________________________________________。
(5)磷酸亚铁锂电池总反应为:FePO4+Li![]() LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
LiFePO4,电池中的固体电解质可传导Li+,试写出该电池放电时的正极反应:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 氯化钠溶液在电流作用下电离成Na+与Cl
B. 溶于水后能电离出H+的化合物都是酸
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. O2的水溶液能不导电,所以O2是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种新型的无机非金属材料,工业上可通过如下反应合成:Al2O3+N2+ 3C![]() 2AlN+3CO,下列说法不正确的是
2AlN+3CO,下列说法不正确的是
A. Al2O3既不是氧化剂也不是还原剂
B. 氧化剂与还原剂物质的量比是1∶3
C. AlN是还原产物
D. 每生成1 mol AlN有2mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Al(NO3)3溶液的叙述正确的是( )
A.该溶液中H+、Fe2+、SO ![]() 、Cl﹣可以大量共存
、Cl﹣可以大量共存
B.向该溶液中通入SO2气体不会发生反应
C.向该溶液中加入过量氨水发生反应的离子方程式Al3++4NH3?H2O═AlO2﹣+4NH4++2H2O:
D.向该溶液中滴入Na2CO3溶液发生反应的离子方程式:2Al3++3CO ![]() +3 H2O═2Al(OH)3↓+3CO2↑
+3 H2O═2Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:
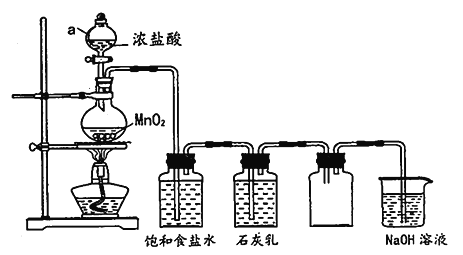
(1)甲装置中仪器a的名称是_____________________。
(2)装置乙中饱和食盐水的作用是_____________________。
(3)①制取漂白粉的化学方程式是______________________________。
②该小组制得的漂白粉中n(CaCl2)远大于n[Ca(ClO)2],则产物中还混杂有物质的化学式是______。
③为提高Ca(ClO)2的含量,,可采取的措施是__________________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________(用化学方程式表示)。
(5)家庭中常用84 消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)清洁卫生。两者同时混合使用会产生有毒的氯气,写出该反应的离子方程式________________________________。
(6)实验室用MnO2跟浓盐酸反应时,当盐酸浓度低于8mol/L时就不能生成氯气。某兴趣小组在圆底烧瓶中实际加入了MnO28.7g,20mL36.5%的浓盐酸(密度1.18g/mL),充分反应后最多能够收集到_______L标准状况下的氯气(保留3位有效数字,不考虑反应过程中溶液体积变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素。
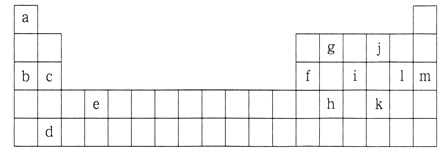
(1)表中所列元素中:
属于短周期元素的有__________;属于主族元素的有_________;e元素在元素周期表中的位置是________周期,_______族。
(2)下列___________组元素的单质可能都是电的良导体。
A.b,c,i B.a,g,k C.c,g,l D.d,e,f
(3)将元素a,b,c,f,1的原子半径按从小到大的顺序排列:________
(4) i元素属于_________(填“金属”或“非金属”)元素,它的最高化合价是________,最低化合价是________。它能与氧气反应,生成一种吸水性很强的物质,这种物质在实验室里常用做干燥剂,写出i的单质与氧气反应的化学方程式:_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com