
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g •L-1 ;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是
A.原子半径:W>Z>Y>X>M B.XZ2 、X2M2 、W2Z2均为共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由Y、Z、M三种元素形成的化合物一定只有共价键
科目:高中化学 来源: 题型:
对金属制品进行抗腐蚀处理,可延长其使用寿命。
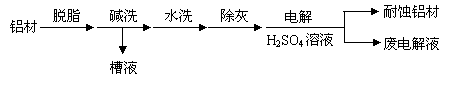 (1)以下为铝材表面处理的一种方法:
(1)以下为铝材表面处理的一种方法:
① 碱洗的目的是除去铝材表面的自然氧化膜,为将碱洗槽液中铝以沉淀形式回收,最好向槽液中加入下列试剂中的 。
a.NH3 b.CO2 c.NaOH d.HNO3
②以铝材为阳极,在H2SO4 溶液中电解,铝材表面形成氧化膜,阳极电极反应为
。取少量废电解液,加入NaHCO3,溶液后产生气泡和白色沉淀,产生沉淀的原因是 。
(2)镀铜可防止铁制品腐蚀,电镀时用铜而不用石墨作阳极的原因是 。
(3)利用下图装置,可以模拟铁的电化学防护。
若X为碳棒,为减缓铁的腐蚀,开关K应置于 处。若X为锌,开关K置于 处。

查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且1 mol 氧气分子中的化学键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式:_______
(2) 若将此燃料电池改为以肼( N2H4)和氧气为原料(其他条件不变),工作时(产物为N2 , H2O)负极电极反应式为______
(3) 用上述氢氧燃料电池作直流电源进行电解,装置如下图所示。若通电5 min时,铜电极质量增加2.16 g。试回答:
① 电源中Y电极为直流电源的__________极。(填“正”或“负”)
② 通电5 min后B中pH变化:________,(填“增大”、“减小”或“不变”)。
③ 通电5 min时氢氧燃料电池中,理论上消耗标准状况下_______L氧气。
④ A中KCl溶液体积也是200 mL,通电5 min后,溶液的OH-浓度_______mol·L-1(设电解前后溶液体积无变化且KCl有剩余)。
⑤ 通电5 min时,B中共收集224 mL气体(标况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为____________(设电解前后溶液体积无变化)。

查看答案和解析>>
科目:高中化学 来源: 题型:
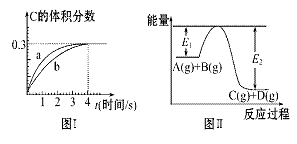
将1 mol A(g)和2 mol B(g)置于2 L某密闭容器中,在一定温度下发生反应:
A(g)+B(g) C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b
C(g)+D(g),并达到平衡。C的体积分数随时间变化如图Ⅰ中曲线b
所示,反应过程中的能量变化如图Ⅱ所示,下列说法不正确的是( )
A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol·L-1·s-1
B.该温度下,反应的平衡常数数值约为7.36
C.恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行
D.在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com