
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且1 mol 氧气分子中的化学键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
科目:高中化学 来源: 题型:
.NA表示阿伏伽德罗常数的值,下列叙述错误的是
A.2gD216O中含有的质子数、中子数、电子数均为NA
B.80g CuO和Cu2S的混合物含有铜原子数一定为NA
C.标准状况下,5.6L O2作氧化剂时转移电子数一定为NA
D.500mL 2mol·L-1Na2CO3溶液中含C微粒总数一定为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
对于短周期元素,下列说法正确的是( )
A、若两元素原子序数相差8,则周期数一定相差1
B、两种简单离子不可能相差3个电子层
C、同族的两元素之间不可能形成化合物
D、最外层电子数相同的元素一定位于同一族
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应热的说法中正确的是
A、一个化学反应是否能在常温下发生与该反应的△H值的大小没有必然联系
B、中和热△H= - 57.3kJ·mol-1,所以1.00L 1.00mol·L-1H2SO4与稀的NaOH溶液恰好完全反应放出57.3kJ的热量
C、用等体积的0.50mol·L-1盐酸、0.55mol·L-1NaOH溶液进行中和热测定的实验,会使测得的值偏大
D、在101KPa时,1molCH4完全燃烧生成CO2和水蒸气放出的热量就是CH4的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76g •L-1 ;W的质子数是X、Y、Z、M四种元素质子数之和的1/2 。下列说法正确的是
A.原子半径:W>Z>Y>X>M B.XZ2 、X2M2 、W2Z2均为共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由Y、Z、M三种元素形成的化合物一定只有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组要完成中和热的测定。(已知t1 为NaOH和HCl起始温度平均值,t2 为终止温度。弱电解质电离是吸热的)
| 实 验 用 品 | 溶 液 温 度 | 中和热 △H | |||
| t1 | t2 | ||||
| ① | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | |
| ② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ |
(1)实验桌上备有烧杯(大.小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、温度计、
0.5mol· L-1 盐酸、0.55mol· L-1NaOH溶液,实验尚缺少的玻璃用品是 、 。
(2)他们记录的实验数据在表格中。 已知:Q=Cm(t2 -t1),反应后溶液的比热容C为4.18KJ·℃-1· Kg-1,各溶液的密度均为1g·cm-3。请根据实验结果(计算中和热结果保留一位小数)写出NaOH溶液与HCl溶液反应的热化学方程式:
(3)该小组所测得中和热与57.3kJ·mol-1有偏差,产生偏差的原因可能是( )
A、实验装置保温隔热效果差
B、量取NaOH溶液的体积时俯视读数
C、NaOH溶液分几次倒入盐酸中
D、用温度计测定NaOH溶液起始温度后,将温度计洗净擦干再测定盐酸溶液的温度
(4) 实验中若用50mL0.5mol· L-1 醋酸代替HCl溶液(其他操作不变),则测得的中和热会有偏差,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置进行相应的实验,能够达到实验目的的是( )
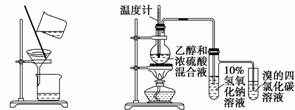
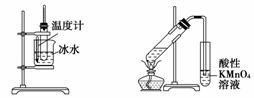
A.分离乙酸乙酯、碳酸钠和水的混合物
B.证明乙醇、浓硫酸共热生成乙烯
C. 实验室制取少量的硝基苯
D. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com