
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况。试判断,违反了泡利原理的是________,违反了洪特规则的是________。

(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)用符号“>”、“<”或“=”表示下列各项关系。
①第一电离能:Na________Mg,Mg________Ca。
②电负性:O________F,F________Cl。
③能量高低:ns________(n+1)s,ns________np。
【答案】(1)②;③、⑤
(2)1s22s22p63s23p4;H2SO4
(3)①;> ②;> ;③<;<
【解析】试题分析:(1)泡利不相容原理:每个原子轨道上最多只能容纳2个自旋状态相反的电子;
洪特规则是指在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同;
所以违反泡利不相容原理的有②,违反洪特规则的有 ③⑤。
故答案为:②;③⑤;
(2)根据激发态原子核外电子排布式知该元素核外有16个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p4,该元素是S元素,S元素最外层有6个电子,其最高化合价是+6价,其最高价氧化物对应的水化物是硫酸,其化学式为H2SO4。
故答案为:1s22s22p63s23p4;H2SO4;
(3)①同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族元素大于相邻元素,同一主族元素中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na<Mg,Mg>Ca。
故答案为:<;>;
②同一周期中,元素的电负性随着原子序数的增大而增大,同一主族中,元素的电负性随着原子序数的增大而减小,所以电负性:O<F,F>Cl。
故答案为:<;>;
③电子的能层越大其能量越高,同一能层的电子,按s、p、d、能量逐渐增大,所以能量高低:ns<(n+1)s,ns<np。
故答案为:<;<。


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 糖类、油脂和蛋白质都是天然高分子化合物
B. 煤的干馏和石油的分馏都是化学变化
C. 苯的硝化反应属于取代反应
D. 油脂都不能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为氮及其化合物的类别与化合价对应的关系图。

(1)实验室制取氨气。
① 化学方程式是 。
② 可用向下排空气法收集氨气的原因是 。
③ 用水吸收多余的氨气时,如将导管直接插入水中,会产生倒吸现象,产生该现象的原因是 。
(2)完成下列能生成NO的化学方程式:
① 体现N元素的还原性:_________。
a.汽车尾气中产生的NO:N2 + O2 ![]() 2NO。
2NO。
b.氨的催化氧化:_________。
② 体现N元素的氧化性:_________。
(3)NO2 易溶于水。将体积为V mL的试管充满NO2后倒扣在水中,见右图。
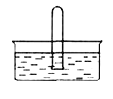
① NO2溶于水的化学方程式是_________。
② 使试管中NO2完全被水吸收的操作是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作中正确的是
A. 洗涤沉淀的方法是直接向过滤器中加入适量蒸馏水,然后让水自然流下
B. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
C. 用100ml量筒量取9.5 mL的液体
D. 焰色反应中,观察焰色后应趁热将铂丝插入到稀硫酸中,然后再次灼烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物
① CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5].羰基镍[Ni(CO)4]。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO的结构式为 ,与CO互为等电子体的离子为 (填化学式)。
② 金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。试推测Ni(CO)4易溶于下列 。
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。镓的基态原子的电子排布式是 ,Ga的第一电离能却明显低于Zn,原因是 。
(3)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是 。
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三种醇同足量的金属钠完全反应,在相同条件下产生相同体积的H2,消耗这三种醇的物质的量之比为3∶6∶2,则A、B、C三种醇分子中,羟基数之比为( )
A.3∶2∶1 B.2∶6∶3
C.3∶1∶2 D.2∶1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大。第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请用对应的元素符号或化学式填空:
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)A的最高价氧化物对应的水化物分子中其中心原子采取 杂化。
(3)与A、B形成的阴离子(AB-)互为等电子体的分子有 。
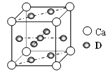
(4)基态D原子的核外电子排布式为 ,右图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比为 。
(5)向D的高价态硫酸盐溶液中逐滴滴加B的氢化物水溶液至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能作为实验判断依据的是( )
A.钠和镁分别与冷水反应,判断钠和镁金属性强弱
B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱
C.硫酸与碳酸的酸性比较,判断硫与碳的非金属性强弱
D.Br2与I2分别与足量的H2反应的难易,判断溴与碘的非金属活动性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(气)+3B(气) ![]() 2C(气)达到平衡的标志是
2C(气)达到平衡的标志是
A.C生成的速率与C分解的速率相等
B.A、B、C的浓度相等
C.A、B、C的分子数比为1:3:2
D.单位时间生成n mol A,同时生成3n mol B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com