
【题目】已知:25℃时 H2C2O4 的 pKa1=1.22,pKa2=4.19,CH3COOH 的 pK a=4.76,K 代表电离平衡常数,pK = -1gK。下列说法正确的是
A. 浓度均为 0.1mol·L-1NH4HC2O4 和 CH3COONH4 溶液中:c(NH4+)前者小于后者
B. 将 0.1mol·L-1 的 K2C2O4 溶液从 25℃升温至 35℃,c(K+)/c (C2O42-) 减小
C. 0.1 mol·L-1K2C2O4 溶液滴加盐酸至 pH=1.22:c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-)
D. 向 0.1 mol·L-1CH3COONa 溶液中滴加少量 0.1 mol·L-1H2C2O4 溶液:CH3COO- + H2C2O4 = CH3COOH + HC2O4
【答案】C
【解析】
A.由已知数据分析可得,HC2O4—的水解程度小于CH3COO—的,HC2O4—对NH4+水解的促进作用小于CH3COO—,故c(NH4+)前者大于后者,则A错误;
B.在0.1 mol·L-1K2C2O 4溶液中存在如下平衡: C2O42-+H2O![]() HC2O4-+OH-,升高温度,平衡右移,c(K+)不变,c(C2O42-)减小,则
HC2O4-+OH-,升高温度,平衡右移,c(K+)不变,c(C2O42-)减小,则![]() 增大,故B说法错误;
增大,故B说法错误;
C.0.1 mol·L-1K2C2O4溶液滴加盐酸至pH=1.22,则生成KCl和H2C2O4,且c(H+)=10-1.22 mol·L-1,已知H2C2O4![]() HC2O4-+H+,Ka1=1.22,所以c(H2C2O4) = c(HC2O4—),由质子守恒可得c(OH-)+c(Cl-)= c(H+)+c(HC2O4—)+2c(H2C2O4),则有c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-),故C说法正确;
HC2O4-+H+,Ka1=1.22,所以c(H2C2O4) = c(HC2O4—),由质子守恒可得c(OH-)+c(Cl-)= c(H+)+c(HC2O4—)+2c(H2C2O4),则有c(H+)-c(OH-)=c(Cl-)-3c(HC2O4-),故C说法正确;
D.由题给信息可知H2C2O4的pKa2=4.19大于CH3COOH的pK a=4.76,说明HC2O4-的电离能力大于CH3COOH,则向0.1mol·L-1CH3COONa溶液中滴加少量0.1 mol·L-1H2C2O4溶液发生的反应为:2CH3COO- + H2C2O4 = 2CH3COOH + C2O42-,故D说法错误;
答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列除去其中较多量杂质的方法(括号内的物质是杂质)正确的是
A. 乙酸乙酯(乙酸):用氢氧化钠溶液洗涤,然后分液。
B. 苯(苯酚):用氢氧化钠溶液洗涤,然后过滤。
C. 硝基苯(苯):用水浴蒸馏。
D. 乙醇(水):加入生石灰搅拌后过滤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表和元素周期律的说法错误的是 ( )
A. Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B. 第二周期元素从Li到F,非金属性逐渐增强
C. 因为Mg比Na会多失去1个电子,所以Mg比Na的金属性强
D. O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用“ Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“Na-CO2”电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,放电反应方程式为4Na+3CO2 =2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示,下列说法中错误的是( )
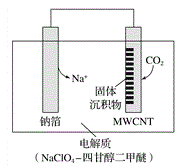
A. 电流流向为:MWCNT→导线→钠箔
B. 放电时,正极的电极反应式为 3CO2+4Na++4e-===2Na2CO3+C
C. 原两电极质量相等,若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e-时,两极的质量差为11.2g
D. 选用髙氯酸钠-四甘醇二甲醚做电解液的优点是导电性好,与金属钠不反应,难挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示实验装置进行相应实验,能达到实验目的的是( )
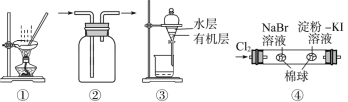
A. 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体
B. 按装置②所示的气流方向可用于收集H2、NH3等
C. 用图③所示装置,分离CCl4萃取I2水后的有机层和水层
D. 用图④所示装置,可以证明氧化性:Cl2>Br2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I某课外小组模拟工业流程,设计了如下实验装置制备硝酸。
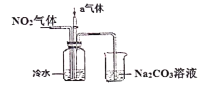
(1)通入的气体a是________(填化学式),通入a的目的是:_________。
(2)盛有Na2CO3溶液的烧杯为尾气处理装置,该装置中反应的化学方程式是: ______NO2+ ______Na2CO3+______ H2O= ______ NaNO2+ ______ + ______NaHCO3
(3)用N2O4代替NO2与水和a气体反应可生成硝酸,此反应的化学方程式是:_________________
Ⅱ按如图装置进行NH3性质实验。
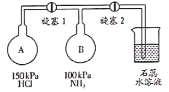
(4)先打开旋塞1,B瓶中的现象是_____________;原因是__________________。稳定后,关闭旋塞1。
(5)再打开旋塞2,B瓶中的现象是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,向反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与产生的沉淀质量的关系如图所示。
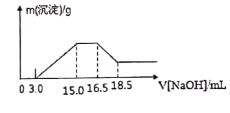
回答下列问题:
(1)写出铝与混合溶液反应的离子方程式:_________________
(2)参加反应硝酸根离子物质的量为____________mol
(3)参加反应的铝与镁的质量比为_______________
(4)混合液中硫酸的物质的量的浓度为_______________mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质之间不能通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| SiO2 | Na2SiO3 | Si | H2SiO3 |
B | Na2O | Na2O2 | Na | NaOH | |
C | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
D | FeCl2 | FeCl3 | Fe | CuCl2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素或生活中常见的金属元素组成的中学常见无机物A、B、C、D、E、X存在如下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是( )
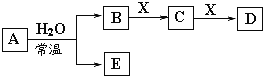
A. 若X是Na2CO3,C为一种温室气体,则A一定是氯气,且D和E不反应
B. 若A是单质,B和D的反应是HCO3- 与OH-反应 ,则E一定能还原Fe2O3
C. 若D为CO,C能和E反应,则A一定为过氧化钠
D. 若C的溶液遇KSCN显红色,则A可能为氮的一种氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com