
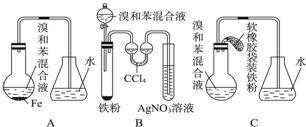
 ,
,分析 (1)A、B、C三种装置都可制取溴苯,都会发生铁与溴的反应、苯与溴的取代反应;
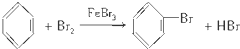
(2)在FeBr3的作用下,苯与液溴发生取代反应,生成溴苯和HBr,由于反应放热,溴、苯沸点低,易挥发,所以从导管导出的气体中可能含有一定的溴和苯;
(3)反应需要铁做催化剂,要使反应开始,应向C中加入铁粉;
(4)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;
(5)双球吸管中四氯化碳吸收了溴和苯;四氯化碳不能盛放太多,否则会被压出,溴易溶于四氯化碳.
解答 解:(1)A、B、C三种装置都可制取溴苯,三个装置中都发生都会发生铁与溴的反应、苯与溴的取代反应,反应的化学方程式为2Fe+3Br2=2FeBr3, ,
,
故答案为:2Fe+3Br2=2FeBr3、 ;
;
(2)在FeBr3的作用下,苯与液溴发生取代反应,生成溴苯和HBr,由于反应放热,溴、苯沸点低,易挥发,所以从导管导出的气体中可能含有一定的溴和苯.故长导管的作用为导气兼冷凝、回流反应物,故答案为:导气兼冷凝、回流反应物;
(3)反应需要铁做催化剂,要使反应开始,应向C中加入铁粉,即托起软橡胶袋使铁粉落入溴和苯组成的混合液中,
故答案为:托起软橡胶袋使铁粉落入溴和苯组成的混合液中;
(4)苯与溴都易挥发,并且有毒,苯与溴逸出会造成环境污染,且苯、溴的逸出,导致利用率减小,
故答案为:苯与溴;Br2和苯的蒸气逸出;
(5)B装置中采用了双球吸收管,利用四氯化碳吸收反应中随HBr逸出的溴和苯的蒸气,双球管内液体不能太多,原因是四氯化碳盛放太多,易被气体压入试管中,反应后双球管中可能出现的现象是CCl4由无色变橙色,
故答案为:吸收反应中随HBr气体逸出的Br2和苯蒸气、CCl4由无色变橙色.
点评 本题考查有机物制备实验及实验装置的应用,为高频考点,把握制备原理及实验装置的作用为解答的关键,侧重分析、实验能力的考查,题目难度中等.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气和氯气反应生成氯化氢气体的热化学方程式是 H2 (g)+Cl2 (g)═2HCl(g) | |
| B. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═+183 kJ•mol-1 | |
| C. | 氢气和氯气反应生成 2 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 | |
| D. | 氢气和氯气反应生成 1 mol 氯化氢气体,反应的△H═-183 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. | 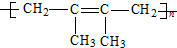 | D. | 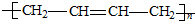 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,属于取代反应.
,属于取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的密度依次增大 | B. | 单质的熔点和沸点依次升高 | ||
| C. | Cl2可以从KI溶液中置换出I2 | D. | Br2可以从NaCl溶液中置换出Cl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com