
| A. | N2分子的电子式: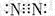 | B. | 中子数为18的氯原子的原子符号: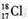 | ||
| C. | 18O2-的结构示意图: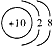 | D. | CO2的比例模型: |
分析 A.氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键;
B.根据符号ZAX的意义以及“质子数(Z)+中子数(N)=质量数(A)”解题;
C.氧离子核内8个质子;
D.碳原子半径大于氧原子半径.
解答 解:A.氮气分子内是通过共用电子对形成共价键;氮原子核外有5个电子,形成氮氮三键,氮分子的电子式为 ,故A正确;
,故A正确;
B.从符号ZAX的意义可知A表示质量数,由质子数(Z)+中子数(N)=质量数(A)得:A=17+18=35,原子符号:1735Cl,故B错误;
C.氧离子核外有10个电子,其电子排布为2、8,所以其结构示意图为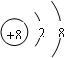 ,故C错误;
,故C错误;
D.二氧化碳的分子式为CO2,由模型可知小球为碳原子,2个大球为氧原子,氧原子半径大,实际碳原子半径大于氧原子半径,故D错误.
故选A.
点评 本题考查了常见化学用语的书写,题目难度中等,涉及电子式、原子结构示意图、元素符号、比例模型等知识,注意掌握常见化学用语的概念及书写原则,审题培养了学生规范答题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖和果糖互为同分异构体 | |
| B. | 淀粉、油脂、蛋白质均能发生水解反应 | |
| C. | 乙醇可使酸性高锰酸钾溶液褪色 | |
| D. | 苯和溴水在FeBr3的条件下可制得溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.
饮用水安全在灾后重建中占有极为重要的地位,为防止灾后疫病要使用大量的各种消毒液,如NaClO溶液,某学习小组对消毒液次氯酸钠(NaClO)的制备与性质进行研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2S溶液中滴入酚酞试液,呈红色 | |
| B. | 升高温度能使FeCl3溶液中的H+浓度增大 | |
| C. | 一切钾盐、钠盐、硝酸盐都不发生水解 | |
| D. | 醋酸盐溶于水能发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
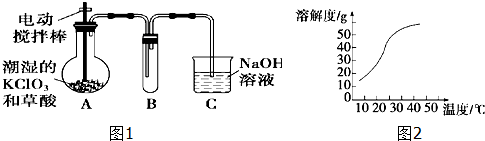
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com