
【题目】下列说法不正确的是 ( )
A.乙醛和丙烯醛(![]() )不是同系物,分别与氢气充分反应后的产物也不是同系物
)不是同系物,分别与氢气充分反应后的产物也不是同系物
B.O2与O3互为同素异形体,1H、2H、3H是氢元素的不同核素
C.C2H6O有两种同分异构体;2-甲基戊烷的结构简式为CH3CH2CH2CH(CH3)2
D.氨基酸分子中均含有羧基(—COOH)和氨基(—NH2)
【答案】A
【解析】
A.乙醛和丙烯醛结构不相似,二者不是同系物,与氢气发生加成反应都生成醇类物质,结构相似,分子组成上相差1个CH2原子团,为同系物,故A错误;
B.O2和O3是氧元素的不同单质,互为同素异形体;1H、2H、3H质子数都为1,中子数分别为0、1、2,它们为氢元素的三种不同的核素,故B正确;
C.C2H6O有乙醇和二甲醚两种同分异构体;CH3CH2 CH2CH(CH3)2的最长碳链含有5个C,主链为戊烷,在2号C含有1个甲基,其名称为2-甲基戊烷,故C正确;
D.氨基酸分子中均含有羧基(-COOH)和氨基(-NH2),如最简单的氨基酸甘氨酸(H2NCH2COOH),故D正确;
故选A。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】用化学知识填空:
(1)丙烷通过脱氢反应可得丙烯。已知:①C3H8(g) = CH4(g)+C2H2(g)+H2(g) ΔH1=+156.6 kJ·mol-1②C3H6(g) = CH4(g)+C2H2(g) ΔH2=+32.4 kJ·mol-1则相同条件下,反应C3H8(g) = C3H6(g)+H2(g)的ΔH=______________ kJ·mol-1。
(2)为减少大气污染,一些城市公共汽车逐步使用CNG(压缩天然气)清洁燃料,实验测得0.16g该气体燃料,完全燃烧生成224ml CO2(标准状况)和0.36g液态水,并放出8.903KJ的热量,请写出:CNG完全燃烧的热化学方程式 ____________________________________________________________
(3)请写出NH4Cl溶液中各离子浓度的大小关系式:______________________________________________
(4) 醋酸在水溶液中的电离方程式为___________________________________________
(5) 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_________(填字母序号)。
A. 滴加少量浓盐酸 B.微热溶液 C.加水稀释 D.加入少量醋酸钠晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)醇烃化新技术是近几年合成氨工业净化精炼原料气,除去少量CO一种新方法,其原理可分为甲醇化与甲烷化两个部分。
甲醇化:CO(g)+2H2(g)CH3OH(g))△H1<﹣116kJmol﹣1
甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)△H2<﹣203kJmol﹣1
(1)下列措施有利于提高醇烃化过程CO转化率的是_____。
A.及时分离出CH3OH B.适当升高反应温度
C.使用高效的催化剂 D.适当增大压强
(2)甲醇化平衡常数![]() 表示,α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=_____(用含w的表达式来表示)
表示,α为平衡组分中各物质的物质的量分数。若CO与H2混合原料气中CO的体积分数为1%,经甲醇化后CO的平衡转化率为w,则Kα=_____(用含w的表达式来表示)
(3)测试a、b两种催化剂在不同压强与温度条件下,甲醇化过程中催化效率如图:

从上图可知选择哪种催化剂较好_____(填a或b),理由是_____。
(4)下列关于醇烃化过程说法正确的是_____。
A.甲醇化与甲烷化过程在任何条件下均为自发反应
B.选择不同的催化剂可以控制醇烃化过程中生成甲醇与甲烷的百分含量
C.当温度与反应容器体积一定时,在原料气中加入少量的悄性气体,有利于提高平衡转化率与甲醇的产率
D.适当增大混合气体中H2的百分含量,有利于提高醇烃化过程CO平衡转化率
(二)“五水共治“是浙江治水的成功典范,其中含氮废水处理是污水治理的一个重要课题,图3是高含氰(CN﹣)废水处理方案:

(5)高含氰废水可以通过电解法进行处理,阳极反应分两个阶段,第一阶段电极反应式:CN﹣+2OH﹣﹣2e﹣=CNO﹣+H2O,请写出第二阶段的电极反应式_____。
(6)电解后低含氰废水通过化学氧化方法处理:在碱性条件下加入NaClO,将CN﹣氧化为碳酸盐与对环境友好气体。请写出相关离子反应方程式_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示:氨气可在纯氧中安静燃烧![]() 某校化学小组学生设计如下装置
某校化学小组学生设计如下装置![]() 图中铁夹等夹持装置已略去
图中铁夹等夹持装置已略去![]() 进行氨气与氧气在不同条件下反应的实验;
进行氨气与氧气在不同条件下反应的实验;

(1)氨气极易溶于水,其水溶液叫做氨水,显______性,能使石蕊试液变______;其原因为____________![]() 用化学方程式和电离方程式表示
用化学方程式和电离方程式表示![]()
(2)图甲是实验室制取纯净、干燥的氨气的装置图,写出大试管内发生反应的化学方程式![]() 采用实验室常用药品制氨气
采用实验室常用药品制氨气![]() :______,A中所加药品为______,所起作用为______.
:______,A中所加药品为______,所起作用为______.
(3)将产生的氨气与过量的氧气通到装置乙中,用酒精喷灯加热后,试管内气体为______色,氨催化氧化的化学方程式是______
(4)将过量的氧气与甲产生的氨气分别从a、b两管进气口通入到装置丙中,并在b管上端点燃氨气,其氧化产物为空气的主要成分之一;
![]() 两气体通入的先后顺序是______;
两气体通入的先后顺序是______;![]() 氨气燃烧的化学方程式是______.
氨气燃烧的化学方程式是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断裂1mol化学键所需要的能量如下:
化学键 | N-N | O=O | N≡N | N-H |
键能kJ·mol-1 | a | 500 | 942 | 391 |
肼(N2H4)的有关反应能量变化如图所示,下列说法正确的是( )

A. 该图表示:1molN2H4与1molO2反应生成1molN2和2molH2O反应热△H=-2752kJ·mol-1
B. a=154
C. N2(g)+2H2O(g)=N2H4(g)+O2(g) △H=+2752kJ·mol-1
D. 当有2molH2O(g)生成时,放出534kJ·mol-1的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化钠和过氧化钠的叙述中不正确的是
A.Na2O2是淡黄色固体,Na2O是白色固体,阴阳离子个数比均为1:2
B.Na2O2和Na2O均为碱性氧化物,都能与水反应生成NaOH
C.Na2O和Na2O2均能与CO2发生反应,都有Na2CO3生成
D.2gH2充分燃烧后产物被Na2O2完全吸收,Na2O2固体增重2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为:2NO2(g)+O3(g)![]() N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度, | 0~3s内,反应速率为: | t1时仅加入催化剂, | 达平衡时,仅改变x,则x为c(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将BaO2放入密闭的真空容器中,反应2BaO2(s)![]() 2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小一半容积,体系重新达到平衡,下列说法不正确的是
A. 气体的平均摩尔质量不变 B. BaO量减小
C. BaO2的转化率减小 D. 体积中密度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某反应在体积为4 L的恒容密闭容器中进行, 在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。

(1)该反应的化学方程式为____________________
(2)反应开始至2分钟时,B的平均反应速率为__________,A的转化率为________________________
(3)能说明该反应已达到平衡状态的是______________
a.容器内气体的颜色保持不变
b.容器内混合气体的密度保持不变
c.v逆(B)= 2v正(C)
d.容器内混合气体的平均相对分子质量不再改变
II.如图是氢氧燃料电池构造示意图。
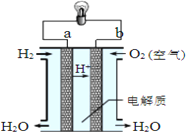
该电池工作时,电子的流向______→_____(填“a”“b”),每生成1 mol H2O则理论上电路中通过的电子数为__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com