
【题目】一定条件下合成乙烯:![]() 。已知温度对
。已知温度对![]() 的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是
的平衡转化率和催化剂催化效率的影响如下图。下列说法正确的是

A.M点的正反应速率![]() 大于N点的逆反应速率v逆
大于N点的逆反应速率v逆
B.若投料比![]() ,则图中M点己烯的体积分数为
,则图中M点己烯的体积分数为![]()
C.![]() ,催化剂对
,催化剂对![]() 平衡转化率的影响最大
平衡转化率的影响最大
D.当温度高于![]() ,升高温度,平衡逆向移动导致催化剂的催化效率降低
,升高温度,平衡逆向移动导致催化剂的催化效率降低
科目:高中化学 来源: 题型:
【题目】光纤通讯是光导纤维传送信号的一种通讯手段,合成光导纤维及氮化硅(一种无机涂层)的工艺流程如下:

回答下列问题:
(1)反应Ⅰ的化学方程式为2C+SiO2 ![]() Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2
Si+2CO↑,其中还原剂为______,产物Si在周期表中位于______,该反应涉及的副反应可能有C+SiO2 ![]() Si+CO2↑(碳不足)和______(碳足量)。
Si+CO2↑(碳不足)和______(碳足量)。
(2)经反应Ⅱ所得的四氯化硅粗品中所含的物质如下:
组分名称 |
|
|
| HCl |
|
|
质量分数 |
|
|
|
|
|
|
沸点 |
|
|
|
|
|
|
图中“操作X”的名称为______;![]() 的电子式为______。
的电子式为______。
(3)反应Ⅳ的化学方程式为3SiCl4+4NH3 ![]() Si3N4+12HCl,若向2L恒容密闭容器中投入1mol
Si3N4+12HCl,若向2L恒容密闭容器中投入1mol![]() 和1mol
和1mol![]() ,6min后反应完全,则
,6min后反应完全,则![]() min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气
min内,HCl的平均反应速率为______molL-lmin-l;反应Ⅲ的与Ⅳ产生的气体相同,则反应Ⅲ化学方程式为______。反应Ⅲ中的原料气![]() 和
和![]() 在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
在碱性条件下可构成燃料电池,其正极反应的电极方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣。则该硬水属于_____(填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加______后加___________。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是______________。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00molL﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为________________。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为______________________。
②含Cr3+废水需进一步处理,请你设计一个处理方案:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应3A(s)+3B(g)=2C(g)+D(g),经3 min,B的浓度减少0.9 mol·L-1。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示的反应速率之比是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在容积均为0.5L的两个密闭容器中发生:2A(g)+B(g)2C(g)△H=﹣Q kJ/mol (Q>0),6min后,容器①中反应达平衡,有关数据如下表,下列叙述中正确的是
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
A. 0-6min,v(A)=0.25mol/(L·min)
B. ②中达平衡时放出的热量为0.05QkJ
C. 其他条件不变,若容器②保持绝热恒容,则达到平衡时C的体积分数小于2/3
D. 若①达平衡后,再通入1molA与0.5molB,再达平衡时A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M是原子序数依次增大的短周期主族元素,Y的最外层电子数是内层电子数的3倍,Y与Z形成的化合物Z2Y3中,元素质量比m(Y):m(Z)=8:9;X原子的最外层电子数为M原子和Z原子最外层电子数的和的一半。下列说法正确的是
A.X的最高价氧化物对应的水化物一定为强酸B.气态氢化物的沸点:Y>M
C.Z是地壳中含量最多的元素D.原子半径:Z>M>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
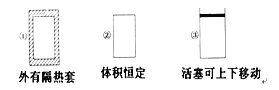
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为![]() 的两个恒容密闭容器中加入足量相同的碳粉,再分别加入
的两个恒容密闭容器中加入足量相同的碳粉,再分别加入![]() 和
和![]() ,在不同温度下反应
,在不同温度下反应![]() 达到平衡,平衡时
达到平衡,平衡时![]() 的物质的量浓度
的物质的量浓度![]() 随温度的变化如图所示
随温度的变化如图所示![]() 图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上
图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()

A.反应![]() 的
的![]()
B.体系的总压强![]() 状态Ⅱ
状态Ⅱ![]() 状态Ⅲ
状态Ⅲ![]()
C.体系中![]() ,状态Ⅱ
,状态Ⅱ![]() ,状态Ⅲ
,状态Ⅲ![]()
D.逆反应速率![]() 状态Ⅰ
状态Ⅰ![]() 状态Ⅲ
状态Ⅲ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:现有两个体积相等的恒容密闭容器,向甲容器中加入1molA和1 molB,乙容器中加入1molX和3molY,两容器中分别发生下列两个反应,反应开始时甲、乙两容器的反应条件相同。

回答下列问题:
(1)反应达到平衡时,甲、乙两容器中平均反应速率v(A)与v(X)的大小关系是___。(填序号)。
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.无法比较
(2)甲中反应达到平衡后,若给甲容器升温,正反应速率将___(填“增大”、“减小”或“不变”)。
(3)表示乙中反应达到平衡的标志是___(填序号)。
①X、Y、Z的物质的量之比为1:3:2
②X、Y、Z的浓度不再发生变化
③容器中的温度不再发生变化
④3v正(Y)=2v逆(Z)
Ⅱ:工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ·mol1
CO2(g)+H2(g) △H=-41kJ·mol1
某化学兴趣小组同学研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
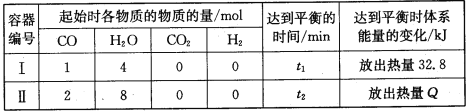
(1)容器Ⅰ中反应达到平衡时,CO的转化率为___。
(2)容器Ⅱ中反应的平衡常数K=___。
(3)下列叙述正确的是___(填字母)。
a.平衡时,两容器中H2 的体积分数相等
b.容器Ⅱ反应达到平衡状态时,Q>65.6
c.反应开始时,两容器中反应的速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com