
| A. | 1.68g | B. | 4.48g | C. | 5.60g | D. | 无法计算 |
分析 反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,计算混合物中O原子物质的量,根据Cu元素守恒计算n(CuO),再根据O原子守恒计算n(Fe2O3),溶液后溶液中氯离子物质的量不变,根据电荷守恒计算n(Fe2+),再根据Fe原子守恒计算n(Fe),根据m=nM计算铁的质量.
解答 解:反应后溶液中还有较多H+离子剩余,且滤液中没有Cu2+,可知残留物没有Fe,只有Cu,而Cu可以残留说明溶液中没有Fe3+,溶液中阳离子为H+和Fe2+,
反应后剩余n(H+)=0.4mol/L×0.2L=0.08mol,原溶液中n(HCl)=4.4mol/L×0.1L=0.44mol,
参加反应的HCl中的H元素转化到氢气、水中,根据H原子守恒,2n(H2O)+2n(H2)=n总(HCl)-n余(H+),即2n(H2O)+2×$\frac{0.224L}{22.4L/mol}$=0.44mol-0.08mol,解得n(H2O)=0.17mol,故混合物中n(O)=n(H2O)=0.17mol,
由铜元素守恒,则n(CuO)=n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,
由O原子守恒:3n(Fe2O3)+n(CuO)=0.17mol,则n(Fe2O3)=0.05mol
由氯离子守恒:2n(Fe2+)+n(H+)=n(Cl-),则n(Fe2+)=$\frac{0.44mol-0.08mol}{2}$=0.18mol,
由Fe原子守恒,n(Fe)=n(Fe2+)-2n(Fe2O3)=0.18mol-0.05mol×2=0.08mol,
故混合物中Fe的质量为0.08mol×56g/mol=4.48g,
故选B.
点评 本题考查混合物计算,注意从溶液存在的离子判断物质反应的程度,注意利用守恒的方法计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CS2的电子式为: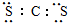 | B. | Ca2+的离子结构示意图为: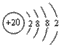 | ||
| C. | HClO的结构式为:H-O-Cl | D. | 氯化铵的电子式为: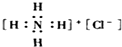 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两者都含s-s σ 键 | B. | 两者都含p-p σ 键 | ||
| C. | 前者含p-p σ 键,后者含s-p σ 键 | D. | 两者都含p-p π 键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
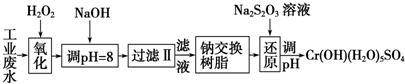
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2溶液 | B. | 稀硝酸和BaCl2溶液 | ||
| C. | 稀硫酸和BaCl2溶液 | D. | 稀盐酸和BaCl2溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com