
 Ⅰ:反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,试回答:
Ⅰ:反应C(s)+H2O(g)?CO(g)+H2(g)在一容积可变的密闭容器中进行,试回答:| 1 | 2 |
| 1 |
| 2 |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不需要通过化学反应就能从海水中获得食盐和淡水 | B、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H>0 | C、从碘水中提取单质碘时,不能用无水乙醇代替CCl4 | D、AgCl分别在同浓度的CaCl2溶液和NaCl溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、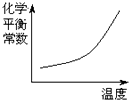 | B、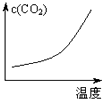 | C、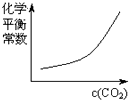 | D、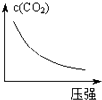 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com